题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、含有大量Fe2+的溶液中:H+、Mg2+、ClO-、NO3- |
| C、c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32-、HCO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.酸性条件下,NO3-具有强氧化性,能氧化还原性离子;
B.酸性条件下,NO3-、ClO-具有强氧化性,能氧化还原性离子;
C.c(H+)=10-12mol?L-1的溶液呈碱性,离子之间不反应且和氢氧根离子不反应;
D.能使Al溶解产生H2的溶液呈强碱性或强酸性,但不能是强氧化性酸,则和氢离子、氢氧根离子的反应不能大量存在.
B.酸性条件下,NO3-、ClO-具有强氧化性,能氧化还原性离子;
C.c(H+)=10-12mol?L-1的溶液呈碱性,离子之间不反应且和氢氧根离子不反应;
D.能使Al溶解产生H2的溶液呈强碱性或强酸性,但不能是强氧化性酸,则和氢离子、氢氧根离子的反应不能大量存在.
解答:
解:A.酸性条件下,NO3-具有强氧化性,能氧化还原性离子Fe2+生成NO和Fe3+,所以不能大量共存,故A错误;
B.酸性条件下,NO3-、ClO-具有强氧化性,能氧化还原性离子Fe2+生成NO或Cl-和Fe3+,所以不能大量共存,故B错误;
C.c(H+)=10-12mol?L-1的溶液呈碱性,这几种离子之间不反应且和氢氧根离子也不反应,所以能大量共存,故C正确;
D.能使Al溶解产生H2的溶液呈强碱性或强酸性,但不能是强氧化性酸,NH4+、HCO3-和氢氧根离子反应而不能大量共存,SiO32-、HCO3-和氢离子反应而不能大量共存,故D错误;
故选C.
B.酸性条件下,NO3-、ClO-具有强氧化性,能氧化还原性离子Fe2+生成NO或Cl-和Fe3+,所以不能大量共存,故B错误;
C.c(H+)=10-12mol?L-1的溶液呈碱性,这几种离子之间不反应且和氢氧根离子也不反应,所以能大量共存,故C正确;
D.能使Al溶解产生H2的溶液呈强碱性或强酸性,但不能是强氧化性酸,NH4+、HCO3-和氢氧根离子反应而不能大量共存,SiO32-、HCO3-和氢离子反应而不能大量共存,故D错误;
故选C.
点评:本题考查离子共存,明确离子性质及离子反应条件是解本题关键,注意隐含条件的挖掘,如AB选项,注意D选项中硝酸和Al反应不能生成氢气,所以要排除硝酸,为易错点.

练习册系列答案
相关题目
 联合国气候变化大会于2010年12月召开,焦点议题之一是发展“低碳经济,节能减排”,减少温室气体排放.你认为下列做法中,不能有效减少空气中CO2含量的是( )
联合国气候变化大会于2010年12月召开,焦点议题之一是发展“低碳经济,节能减排”,减少温室气体排放.你认为下列做法中,不能有效减少空气中CO2含量的是( )| A、开发利用太阳能、风能、生物能、海洋能等清洁能源 |
| B、使用节能产品,推广节能环保汽车 |
| C、植树造林,增加森林植被面积 |
| D、用脱硫处理的煤代替原煤作燃料 |
与Ne核外电子排布相同的离子跟与Ar核外电子排布相同的离子形成的化合物是( )
| A、MgBr2 |
| B、Na2S |
| C、KCl |
| D、NaF |
结构决定性质:如最外层电子数决定元素性质,“官能团”是决定有机物性质的原子或原子团.下列原子团不是有机“官能团”的是( )
| A、-CH3 |
| B、-CHO |
| C、-COOH |
| D、-OH |
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
| A、pH=3的醋酸和pH=11氢氧化钠溶液 |
| B、pH=2的硫酸和pH=12的氢氧化钠溶液 |
| C、pH=3的盐酸和pH=11的氨水 |
| D、pH=2的硝酸和pH=12的氢氧化钠溶液 |
盐酸能发生下列反应:①Zn+2HCl═ZnCl2+H2↑②2HCl+CuO═CuCl2+H2O ③MnO2+4HCl═MnCl2+Cl2↑+2H2O,因此盐酸具有的性质是( )
| A、只有酸性 |
| B、只有氧化性 |
| C、只有还原性 |
| D、以上三种均具有 |
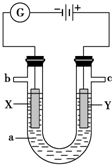 如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题: