题目内容
8.短周期元素X、Y、Z、W、M的原子序数依次增大,其中X、W同主族,Y+与X2-具有相同的电子层结构;离子半径:W2->M-,Z的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )| A. | 原子最外层电子数:X>Y>Z | |
| B. | 原子半径:X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 最简单气态氢化物的稳定性:X>W>M |
分析 X、Y、Z、W、M五种短周期元素,Z的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Z为Si;由Y+与X2-具有相同的电子层结构,可知Y为Na、X为O;X、W同主族,则W为S;离子半径W2->M-,则M为Cl,以此解答该题.
解答 解:X、Y、Z、W、M五种短周期元素,Z的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Z为Si;由Y+与X2-具有相同的电子层结构,可知Y为Na、X为O;X、W同主族,则W为S;离子半径W2->M-,则M为Cl,
A.X为O、Y为Na、Z为Si,最外层电子数分别为6、1、4,则最外层电子数多少为:X>Z>Y,故A错误;
B.X为O、Y为Na、Z为Si,电子层越多,原子半径越大,则原子半径大小为:Y>Z>X,故B错误;
C.W为S、Z为Si,非金属性S>Si,则最高价氧化物对应水化物的酸性:W>Z,故C正确;
D.X为O、W为S、M为Cl,非金属性越强,对应简单氢化物越稳定,则最简单气态氢化物的稳定性大小为:X>M>W,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,“Z的单质晶体熔点高、硬度大,是一种重要的半导体材料”是推断突破口,明确元素周期律内容、元素周期表结构为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.下列关于电解质的说法正确的是( )
| A. | 铜能导电但属于非电解质 | |
| B. | 氯化氢气体不能导电,所以氯化氢是非电解质 | |
| C. | 电解质不一定能导电 | |
| D. | SO2溶于水形成的溶液能导电,所以SO2是电解质 |
19.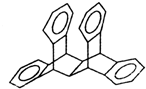 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是
( )
 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
| A. | 该有机物的一氯代物只有4种(不包括立体异构) | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物属于苯的同系物 | |
| D. | 该有机物只能发生取代反应而不能发生加成反应 |
16.氨基钠和氢化钠与水反应的化学方程式如下:①NaNH2+H2O═NaOH+NH3↑②NaH+H2O═NaOH+H2↑,下列叙述正确的是( )
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 熔融氢化钠不导电 | |
| D. | 方程式①中,氨基钠是还原剂 |
20.某有机物M的分子式为C5H12O,它能和钠反应产生氢气,且它是烯烃在一定条件下与水发生加成反应的产物,M的结构有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
18.用NA表示阿伏伽德罗常数的值,下列有关说法中正确的是( )
| A. | 200mL 2mol/L蔗糖溶液中所含分子数为0.4NA | |
| B. | 标准状况下,2.24L HF的氢原子数目为0.1 NA | |
| C. | 黑火药爆炸的方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑,当生成1molK2S时转移电子数为2NA | |
| D. | 标准状况下,1.12L 1H2和0.2g2H2均含有0.1 NA质子 |
