题目内容
2.甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备CH3OH(g).已知某些化学键的键能数据如表:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备CH3OH(g)的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
(2)在恒温恒容时,下列说法中能表明上述反应达到平衡状态的有ABD.
A.CO的物质的量不再变化B.v(H2)正=2v(CH3OH)逆
C.混合气体的密度不再变化D.混合气体的平均相对分子质量不再变化
(3)某研究小组在初始投料量相同的条件下,分别在250℃、300℃、350℃模拟以上工业生产进行实验,测定不同温度下CO的平衡转化率与压强的关系如图1所示.(A、B、C分别表示不同温度)

①TC=350℃;KA>KB(填“>”、“<”或“=”)
②实际生产时,通常选择温度为A℃、压强1.3×104kPa左右,选择此压强的理由是此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本.
(4)如图2,常温下,利用甲醇燃料电池电解100mL 0.1食盐水,电解一段时间后,收集到氢气0.224L(已换算成标况下,忽略电解前后溶液体积的变化).
①电解后恢复至常温,U型管中溶液的pH=13(忽略Cl2与NaOH的反应)
②继续电解一段时间,将燃料电池中产生的0.1mol CO2通入到含有0.15mol NaOH的溶液中,则所得溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 (1)依据化学反应焓变=反应物键能总和-生成物键能总和计算,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意该反应是在一个反应前后气体体积不变的容器中进行的反应;
(3)①升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃;平衡常数与压强无关,只与温度有关,结合平衡移动判断;
②由图可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大成本;
(4)①根据电解氯化钠溶液的电解方程式来求溶液的PH;②先判断CO2和NaOH溶液反应的产物,然后根据水解来解答.
解答 解:(1)CO(g)+2H2(g)?CH3OH (g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,)△H1═1072KJ/mol+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,热化学方程式CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1,
故答案为:CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)A.CO的物质的量不再变化,浓度不变,表明上述反应达到平衡状态,故A正确;
B.v(H2)正=2v(CH3OH)逆能说明正逆反应速率相等,即化学反应达到平衡,故B正确;
C.反应是前后都是气体,气体质量不变,恒温恒容,体积不变,混合气体的密度ρ=$\frac{m}{v}$,始终不变,故C错误;
D.容器内气体的平均摩尔质量等于总质量除以总物质的量,质量守恒保持不变,但是n变化,当气体的平均摩尔质量不变了,证明达到平衡,故D正确;
故答案为:ABD;
(3)①CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,相同压强下,温度越高,CO的转化率越小,所以A为250℃,B为300℃,平衡常数与压强无关,只与温度有关,相同压强下,温度越高,CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故Ka>Kb,
故答案为:350;>;
②由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本;
(4)①由方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑
2 1
0.01mol $\frac{0.224L}{22.4L/mol}$=0.01mol
由题可知:之后反应为直接电解水,溶液pH值不改变,C(H+)═$\frac{1{0}^{-14}}{\frac{0.01mol}{0.1L}}$=10-13mol/L,所以PH=13,
故答案为13;
②由反应:CO2 +2NaOH═Na2CO3+H2O,CO2 +NaOH═NaHCO3,CO2 与NaOH的物质的量之比=0.1:0.15=1:1.5,故CO2 与NaOH都完全反应,所得产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:x+y=0.1,2x+y=0.15,联立方程解得x=y=0.05,
所以产物为0.05molNa2CO3,0.05molNaHCO3,因CO32-水解,溶液呈碱性,溶液呈碱性,则c(OH-)>c(H+),盐水解程度较小,则c(HCO3-)>c(CO32-),水中OH-来源于CO32-、HCO3-水解及水的电离,水的电离程度很小,则c(CO32-)>c(OH-),所以c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查热化学方程式的书写、化学平衡图象及影响因素、化学平衡状态判断、电化学、水解平衡等知识,综合性较强,注意掌握化学平衡常数的应用、化学平衡图象及影响因素,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | C、H | B. | Li、Na | C. | Si、P | D. | F、Cl |
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 将FeCl3溶液加热蒸干可以制取较纯净的FeCl3固体 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
| A. | 单质碘(I2) | B. | 碘化钠中化合态的碘(I-) | ||
| C. | 碘酸钠中的碘元素 | D. | 氯化碘(ICl)中的碘元素 |
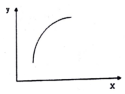 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)?MgO(S)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)?MgO(S)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | SO2的浓度 | 平衡常数K |
| B | 温度 | 容器内混合气体的密度 |
| C | CO的物质的量 | CO2与CO的物质的量之比 |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 一定有N2、CO和HCl | B. | 一定有N2,CO和HCl中至少有一种 | ||
| C. | 一定有N2和HCl | D. | 一定有N2和CO |