题目内容
12.下列各组的两种元素,属于同一周期的是( )| A. | C、H | B. | Li、Na | C. | Si、P | D. | F、Cl |
分析 原子结构中,具有相同电子层的原子,在同一周期,以此来解答.
解答 解:A.C在第二周期、H在第一周期,故A错误;
B.Li在第二周期、Na在第三周期,故B错误;
C.Si、P的原子结构中均有3个电子层,均位于第三周期,故C正确;
D.F在第二周期,Cl在第三周期,故D错误.
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,侧重元素位置的考查,注意把握原子的电子层数等于周期数的关系,熟悉常见元素的位置即可解答,题目难度不大.

练习册系列答案
相关题目
14.既可以使溴水褪色,又可以使酸性高锰酸钾溶液褪色的气体有( )
| A. | CO | B. | CO2 | C. | C2H4 | D. | C2H6 |
7.现有一种烃可表示为 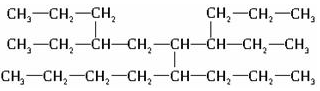 该烃主链的碳原子数应是
该烃主链的碳原子数应是
( )
 该烃主链的碳原子数应是
该烃主链的碳原子数应是( )
| A. | 11 | B. | 9 | C. | 10 | D. | 12 |
17.下列说法不正确的是( )
| A. | 欲检验蔗糖水解产物是否具有还原性,不可以向水解后的溶液中直接加入新制的Cu(OH)2并加热 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 | |
| D. | 迷迭香酸的结构为 它可以发生酯化、水解、加成等反应 它可以发生酯化、水解、加成等反应 |
4.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( )

| A. | 该分子式为C19H16O7 | |
| B. | 能发生氧化、取代、消去反应 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
1.下列关于有机化合物的说法正确的是( )
| A. | 油脂和蛋白质都属于高分子化合物 | |
| B. | 丁烷有3种同分异构体 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
2.甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备CH3OH(g).已知某些化学键的键能数据如表:
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备CH3OH(g)的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
(2)在恒温恒容时,下列说法中能表明上述反应达到平衡状态的有ABD.
A.CO的物质的量不再变化B.v(H2)正=2v(CH3OH)逆
C.混合气体的密度不再变化D.混合气体的平均相对分子质量不再变化
(3)某研究小组在初始投料量相同的条件下,分别在250℃、300℃、350℃模拟以上工业生产进行实验,测定不同温度下CO的平衡转化率与压强的关系如图1所示.(A、B、C分别表示不同温度)

①TC=350℃;KA>KB(填“>”、“<”或“=”)
②实际生产时,通常选择温度为A℃、压强1.3×104kPa左右,选择此压强的理由是此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本.
(4)如图2,常温下,利用甲醇燃料电池电解100mL 0.1食盐水,电解一段时间后,收集到氢气0.224L(已换算成标况下,忽略电解前后溶液体积的变化).
①电解后恢复至常温,U型管中溶液的pH=13(忽略Cl2与NaOH的反应)
②继续电解一段时间,将燃料电池中产生的0.1mol CO2通入到含有0.15mol NaOH的溶液中,则所得溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备CH3OH(g)的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
(2)在恒温恒容时,下列说法中能表明上述反应达到平衡状态的有ABD.
A.CO的物质的量不再变化B.v(H2)正=2v(CH3OH)逆
C.混合气体的密度不再变化D.混合气体的平均相对分子质量不再变化
(3)某研究小组在初始投料量相同的条件下,分别在250℃、300℃、350℃模拟以上工业生产进行实验,测定不同温度下CO的平衡转化率与压强的关系如图1所示.(A、B、C分别表示不同温度)

①TC=350℃;KA>KB(填“>”、“<”或“=”)
②实际生产时,通常选择温度为A℃、压强1.3×104kPa左右,选择此压强的理由是此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本.
(4)如图2,常温下,利用甲醇燃料电池电解100mL 0.1食盐水,电解一段时间后,收集到氢气0.224L(已换算成标况下,忽略电解前后溶液体积的变化).
①电解后恢复至常温,U型管中溶液的pH=13(忽略Cl2与NaOH的反应)
②继续电解一段时间,将燃料电池中产生的0.1mol CO2通入到含有0.15mol NaOH的溶液中,则所得溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 如图为以惰性电极进行电解的装置:
如图为以惰性电极进行电解的装置: