题目内容
6.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )| A. | H2S的电子式 | B. | Cl-的结构示意图 | C. | CO2的电子式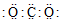 | D. | 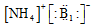 |
分析 A.硫化氢为共价化合物,硫原子与两个氢原子分别共用1对电子;
B.氯离子核内有17个质子,核外有18个电子,有3个电子层分别容纳2,8,8个电子;
C.二氧化碳中碳原子与两个氧原子分别共用2对电子;
D.溴化铵为离子化合物,铵根离子与溴离子通过离子键结合.
解答 解:A.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故A错误;
,故A错误;
B.Cl-是由氯原子得一个电子形成的,故核内有17个质子,核外有18个电子,结构示意图为: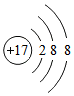 ,故B正确;
,故B正确;
C.CO2 中C分别为O形成2对共价键,电子式为: ,故C错误;
,故C错误;
D.溴化铵为离子化合物,阳离子为原子团,电子式中需要标出N、H原子的最外层电子数,溴化铵的电子式为: ,故D错误;
,故D错误;
故选:B.
点评 本题考查了原子结构示意图、电子式的书写,明确离子化合物与共价化合物的电子式的表示方法及区别是解题关键,题目难度不大.

练习册系列答案
相关题目
15.下列有关物质的用途中,运用了物质的化学性质的是( )
| A. | 用胶状氢氧化铝凝聚水中的悬浮物进行净水 | |
| B. | 用红棕色氧化铁制造红色油漆 | |
| C. | 氢氧化铝作为医用的胃酸中和剂 | |
| D. | 用氧化铝制造耐火坩埚和耐火管 |
17.在恒温、恒容下发生反应:A(s)+B(g)=C(g)+D(g)△H<0.则下列判断正确的是( )
| A. | 向该容器中加入少量A,反应速率增大 | |
| B. | 向该容器中充入氩气,反应速率增大 | |
| C. | 将粉末状A代替块状A能加快反应 | |
| D. | 该反应为放热反应,无需加热即可发生 |
14.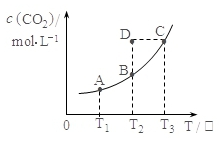 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T 2时,若反应处于状态D,则一定有V 正<V 逆 | |
| C. | 反应CO(g)+H 2O(g)?CO 2(g)+H 2(g) 的△H>0 | |
| D. | 若T 1、T 2时的平衡常数分别为K 1、K 2,则K 1<K 2 |
1.以下变化明显吸热的是( )
| A. | 盐酸与NaOH溶液混合 | B. | 固体NaCl加入水中 | ||
| C. | 固体NH4Cl加入水中 | D. | 固体CaO加入水中 |
11.分离提纯是化学实验中常用的操作,下列不能用于分离提纯操作的仪器是( )
| A. | 普通漏斗 | B. | 长颈漏斗 | C. | 分液漏斗 | D. | 蒸发皿 |
15.A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小.下列叙述错误的是( )
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 电解熔融化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |
16.下列变化在指定条件下通过一步反应就能完成的是( )
| A. | S$→_{点燃}^{O_{2}}$SO3 | B. | Fe$\stackrel{稀盐酸}{→}$FeCl3 | C. | SiO2$\stackrel{水}{→}$H2SiO3 | D. | NO2$\stackrel{水}{→}$HNO3 |
