题目内容
16.下列变化在指定条件下通过一步反应就能完成的是( )| A. | S$→_{点燃}^{O_{2}}$SO3 | B. | Fe$\stackrel{稀盐酸}{→}$FeCl3 | C. | SiO2$\stackrel{水}{→}$H2SiO3 | D. | NO2$\stackrel{水}{→}$HNO3 |
分析 A、硫与氧气反应生成二氧化硫;
B、盐酸是弱氧化剂;
C、二氧化硅不溶于水也不与水反应;
D、二氧化氮与水反应生成硝酸.
解答 解:A、硫与氧气在点燃的条件下反应生成二氧化硫,而不是三氧化硫,故A错误;
B、盐酸是弱氧化剂,铁与盐酸反应生成氯化亚铁,而不是氯化铁,故B错误;
C、二氧化硅不溶于水也不与水反应,故C错误;
D、二氧化氮与水反应生成硝酸和一氧化氮,故D正确;
故选D.
点评 熟练掌握常见物质的性质与变化规律,是解答此类问题的基本的知识基础,难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
6.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | H2S的电子式 | B. | Cl-的结构示意图 | C. | CO2的电子式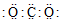 | D. | 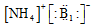 |
7.在含有大量的K+、HCO3-、SO42-的溶液中,还可能大量存在的离子是( )
| A. | NH4+ | B. | H+ | C. | OH- | D. | Ba2+ |
4.给定条件下,下列选项中所示的物质间转化均能一步实现的组合是( )
| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | HCl(aq)$\stackrel{MnO_{2}}{→}$Cl2$\stackrel{澄清石灰水}{→}$Ca(ClO)2 | |
| C. | N2$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{O_{2}、H_{2}O}{→}$HNO3 | |
| D. | 饱和NaCl溶液$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2O3 |
11.下列有关离子方程式书写正确的是( )
| A. | 向氯化铝溶液中加入过量氨水:AL3++3NH3•H2O=A1(OH)3↓+3NH4+ | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+=CO2+H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 化亚铁溶液中通人少量氯气:Cl2+2Fe2+=2Fe3++2CL- |
1.下列物质的性质与应用关系的描述不正确的是( )
| A. | 氧化镁的熔点高,是优质的耐高温材料 | |
| B. | 钠具有强还原性,可用于制取钛、锆等金属 | |
| C. | 氯气有强氧化性,可用氯气漂白干燥的有色布条 | |
| D. | 硝酸是一种强酸,可用浓硝酸清除水壶中的水垢 |
8.下列化学方程式或离子方程式表达正确的是( )
| A. | 将氯化镁溶液加热蒸干:MgCl2+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ MgCl2•6H2O | |
| B. | 碘水中通适量SO2:I2+SO2+H2O═4H++2I-+SO42- | |
| C. | 氯化铝溶液加入足量氨水:A13++4NH3•H2O=A1O2-+4NH4++2H2O | |
| D. | 氯化铁溶液滴加少量氢硫酸:2Fe3++H2S=2Fe2++S↓+2H+ |
5.一定条件下,在体积为2L的密闭容器中,3molX和3molY发生反应:3X(g)+Y(g)?2Z(g)△H>0,经60s达到平衡,生成0.4molZ.下列说法正确的是( )
| A. | 60s内反应速率为v(X)=0.05mol/(L•s) | |
| B. | 其它条件不变,升高温度,正反应速率增大,逆反应速率减小 | |
| C. | 其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | |
| D. | 其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的一半 |
1.下列说法正确的是( )
| A. | 硅是制造光导纤维的材料 | |
| B. | 二氧化硅是制造光电池常用材料 | |
| C. | 陶瓷含有的主要成分是硅酸盐 | |
| D. | 水泥、沙子、水玻璃的成分是二氧化硅 |