题目内容
写出下列物质的电子式
NaOH: 、NH4Cl: 、CO2: 、HClO: 、NH3: .
NaOH:
考点:电子式
专题:化学用语专题
分析:氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子.
解答:
解:氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为:
;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为
;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,
,
故答案为: ;
; ;
; ;
; ;
; .
.
 ;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为:
;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为
;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,
,故答案为:
 ;
; ;
; ;
; ;
; .
.
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
在核磁共振氢谱中出现三组峰的化合物是( )
A、 |
B、 |
C、 |
D、 |
在给定条件下,下列加点的物质在化学反应中能被完全消耗的是( )
A、用H2O2与
| ||||||||
B、将6.4g
| ||||||||
C、含少量CO2的
| ||||||||
D、将2.7g
|
下列指定微粒的个数比为2:1的是( )
| A、Be2+离子中的质子和电子 | ||
B、
| ||
| C、NaOH晶体中的阳离子和阴离子 | ||
| D、Na2O2固体中的阴离子和阳离子 |
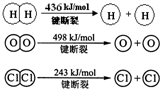
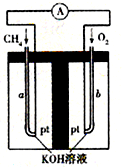
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).