题目内容
I.已知:反应
4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
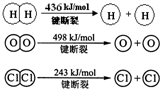
(1)H2与O2反应生成气态水的热化学方程式是 .
(2)断开1mol H-O 键所需能量约为 kJ.
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=
,它所对应的化学方程式为: .
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
请完成下列问题:
①判断该反应的△H 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号).
A.3v(B)(正)=2v(C)(逆)B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变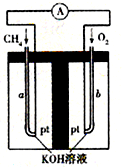
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示.
①放电时,负极的电极反应式为 .
②假设装置中盛装100.0mL 3.0mol?L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960mL.放电完毕后,电解质溶液中各离子浓度的大小关系为 .
4HCl(g)+O2(g)
| CuO/CuCI |
| 400℃ |
H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol

(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1mol H-O 键所需能量约为
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=
| c(H2)c(CO) |
| c(H2O) |
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol?L-1)2 | 4×106 | 8×107 | K1 | … |
①判断该反应的△H
②在一定条件下,能判断该反应一定达化学平衡状态的是
A.3v(B)(正)=2v(C)(逆)B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变

(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示.
①放电时,负极的电极反应式为
②假设装置中盛装100.0mL 3.0mol?L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960mL.放电完毕后,电解质溶液中各离子浓度的大小关系为
考点:热化学方程式,反应热和焓变,化学电源新型电池,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:Ⅰ、(1)根据盖斯定律来解答;
(2)依据反应热=拆化学键吸收的能量-形成化学键放出的能量来解答;
Ⅱ、(1)根据平衡常数的定义判断反应的方程式;
(2)计算浓度商和平衡常数减小比较判断反应进行的方向,若Q=K,反应达到平衡,Q<K,反应正向进行,Q>K反应逆向进行;使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,需要改变条件 满足化学反应速率增大,且平衡正向进行;
(3)分析图表平衡常数温度升高,平衡常数增大,平衡正向进行,正反应为吸热反应;结合平衡移动原理分析,正逆反应速率相同,各组分含量保持不变分析选项;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子;
②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.
(2)依据反应热=拆化学键吸收的能量-形成化学键放出的能量来解答;
Ⅱ、(1)根据平衡常数的定义判断反应的方程式;
(2)计算浓度商和平衡常数减小比较判断反应进行的方向,若Q=K,反应达到平衡,Q<K,反应正向进行,Q>K反应逆向进行;使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,需要改变条件 满足化学反应速率增大,且平衡正向进行;
(3)分析图表平衡常数温度升高,平衡常数增大,平衡正向进行,正反应为吸热反应;结合平衡移动原理分析,正逆反应速率相同,各组分含量保持不变分析选项;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子;
②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.
解答:
解:Ⅰ、(1)①H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol
②4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
根据盖斯定律①×2+②得:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;
(2)2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,则得到H-O的键能=463.4kJ;
故答案为:463.4;
Ⅱ(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g);
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=
=0.5,所以该状态是平衡状态,正逆反应速率相等,
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,
A.反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡逆向进行,故A正确;
B.反应是放热反应,升高温度,速率增大,平衡逆向进行,故B错误;
C.加催化剂改变反应速率,不改变平衡,故C错误;
D.使氨气液化移走,平衡正向进行,反应速率减小,故D错误;
故答案为:=;A;
(3)①图表分析可知,平衡常数随温度升高增大,说明正反应为吸热反应,△H>0,故答案为:>;
②A(g)+3B(g)?2C(g)+D(s)△H>0,
A.反应速率之比等于化学方程式计量数之比,2v(B)(正)=3v(C)(逆),说明C的正逆反应速率相同,反应达到平衡状态,但3v(B)(正)=2v(C)(逆)不能说明反应达到平衡状态,故A错误;
B.A和B的转化率相等与起始量、变化量有关,不能说明反应达到平衡状态,故B错误;
C.反应前后气体体积减小,容器内压强保持不变,说明反应达到平衡状态,故C正确;
D.反应前后气体质量减小,体积不变,混合气体的密度保持不变说明反应达到平衡状态,故D正确;
故答案为:CD;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,负极是甲烷失电子在碱溶液中生成碳酸根离子,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O;
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为
=0.4mol,根据电子转移守恒可知,生成二氧化碳为
=0.2mol,n(NaOH)=0.1L×3.0mol?L-1=0.3mol,n(NaOH):n(CO2)=0.3mol:0.2mol=3:2,介于1:1与2:1之间,故生成碳酸钾、碳酸氢钾,令碳酸钾、碳酸氢钾的物质的量分别为xmol、ymol,则x+y=0.2,2x+y=0.3,解得x=0.1,y=0.1,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②4HCl(g)+O2(g)
| ||
| 400℃ |
根据盖斯定律①×2+②得:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;
(2)2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,则得到H-O的键能=463.4kJ;
故答案为:463.4;
Ⅱ(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g);
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=
| 4×4 |
| 4×23 |
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,
A.反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡逆向进行,故A正确;
B.反应是放热反应,升高温度,速率增大,平衡逆向进行,故B错误;
C.加催化剂改变反应速率,不改变平衡,故C错误;
D.使氨气液化移走,平衡正向进行,反应速率减小,故D错误;
故答案为:=;A;
(3)①图表分析可知,平衡常数随温度升高增大,说明正反应为吸热反应,△H>0,故答案为:>;
②A(g)+3B(g)?2C(g)+D(s)△H>0,
A.反应速率之比等于化学方程式计量数之比,2v(B)(正)=3v(C)(逆),说明C的正逆反应速率相同,反应达到平衡状态,但3v(B)(正)=2v(C)(逆)不能说明反应达到平衡状态,故A错误;
B.A和B的转化率相等与起始量、变化量有关,不能说明反应达到平衡状态,故B错误;
C.反应前后气体体积减小,容器内压强保持不变,说明反应达到平衡状态,故C正确;
D.反应前后气体质量减小,体积不变,混合气体的密度保持不变说明反应达到平衡状态,故D正确;
故答案为:CD;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,负极是甲烷失电子在碱溶液中生成碳酸根离子,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O;
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为
| 8.96L |
| 22.4L/mol |
| 0.4mol×4 |
| 8 |
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评:本题考查热化学方程式书写、化学平衡常数、平衡移动相关计算、原电池等,题目较为综合,涉及多方面的知识,难度中等,注意平衡标志判断,离子浓度大小比较的解题应用.

练习册系列答案
相关题目
下列实验操作中正确的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、萃取操作时,选择的萃取剂的密度必须比水大 |
| D、蒸馏操作时,冷水从下口入,上口出 |
 表示的分子式
表示的分子式