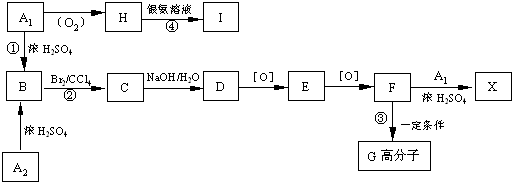
题目内容
焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜.其反应式为:
NH4C1+ CuO→ Cu+ CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况.
(2)该反应中,氧化剂和还原剂的物质的量之比为: .
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为 L.
(1)配平,并用双线桥法标出电子转移情况.
(2)该反应中,氧化剂和还原剂的物质的量之比为:
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)根据Cu元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应,转移电子数=2×(3-0)=3×(2-0)=6;
(2)该反应中氧化剂为CuO,还原剂为NH4C1,有(1)中双线桥可知,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为
=0.05mol,带入V=nVm计算.
(2)该反应中氧化剂为CuO,还原剂为NH4C1,有(1)中双线桥可知,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为
| 0.3mol |
| 6 |
解答:
解:(1)根据Cu元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应得2NH4C1+4CuO=3Cu+CuC12 +N2↑+4H2O,转移电子数=2×(3-0)=3×(2-0)=6,双线桥法标出电子转移情况为:
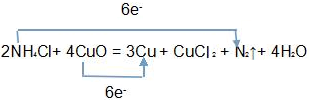 ,
,
故答案为:2NH4C1+4CuO=3Cu+CuC12 +N2↑+4H2O
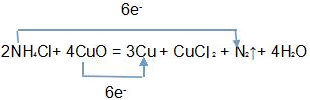 ;
;
(2)该反应中氧化剂为CuO,还原剂为NH4C1,有(1)中双线桥可知,4molCuO参与反应,做氧化剂的为3mol,氧化剂和还原剂的物质的量之比为3:2,
故答案为:3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为
=0.05mol,
则产生的N2在标准状况下的体积V=nVm=0.05mol×22.4L/mol=1.12L,
故答案为:1.12.
 ,
,故答案为:2NH4C1+4CuO=3Cu+CuC12 +N2↑+4H2O
 ;
;(2)该反应中氧化剂为CuO,还原剂为NH4C1,有(1)中双线桥可知,4molCuO参与反应,做氧化剂的为3mol,氧化剂和还原剂的物质的量之比为3:2,
故答案为:3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为
| 0.3mol |
| 6 |
则产生的N2在标准状况下的体积V=nVm=0.05mol×22.4L/mol=1.12L,
故答案为:1.12.
点评:本题考查氧化还原反应得配平及有关计算,根据电子守恒及质量守恒定律得出化学反应方程式是解答本题的关键,并注意(2)是学生解答的难点和易错点,4molCuO参与反应与作氧化剂的区别,难度中等.

练习册系列答案
相关题目
已知某温度下CH3COOH和NH3?H2O 的电离常数相等.现向10mL浓度为0.1mol?L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,下列说法不正确的是( )
| A、水的电离程度先增大,后又减小 |
| B、c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| C、溶液导电性先增强后减弱 |
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
下列电池工作时,O2在正极放电的是( )
 |  |  |  |
| A.甲醇燃料电池 | B.镍镉电池 | C.锌锰电池 | D.铅蓄电池 |
| A、A | B、B | C、C | D、D |
某化学兴趣小组把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀A生成.再过滤,加热至恒重得到B.对物质A、B该小组有如下四种判断,你认为正确的是( )
| A、Fe(OH)3; Fe2O3 |
| B、Fe(OH)2; FeO |
| C、Fe(OH)3、Fe(OH)2;Fe3O4 |
| D、Fe2O3;Fe(OH)3 |
化学与社会、生产、生活密切相关.下列说法正确的是( )
| A、加快化石燃料的开采和使用 |
| B、NaHCO3可用于治疗胃酸过多 |
| C、明矾可用于水的杀菌消毒 |
| D、从海水中提取物质都必须通过化学反应才能实现 |
一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1,测得0到10秒内,c(H2)减小了0.75mol?L-1,下列说法正确的是( )
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、化学反应速率关系是:3υ正(H2)=2υ正(NH3) |
| C、达平衡后,分离出少量NH3,V正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |