题目内容
9.H2SO4的摩尔质量为( )| A. | 96g | B. | 96g/mol | C. | 98g | D. | 98g/mol |
分析 摩尔质量是单位物质的量的物质的质量,单位为g/mol,
解答 解:硫酸H2SO4的摩尔质量=(1×2+32+4×16)g/mol=98g/mol,
故选D.
点评 本题考查了摩尔质量的概念,主要是概念实质理解应用,掌握概念理解实质是解题关键,题目较简单.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
19.下列说法中正确的是( )
| A. | 符合通式Cm(H2O)n的一定是糖 | |
| B. | 糖类组成一定符合通式Cm(H2O)n | |
| C. | 糖类是人类维持生命的六大类营养素之一 | |
| D. | 糖类是有甜味的物质 |
20.工业上曾经利用铝热反应焊接钢轨,现在高层建筑爆破中常用铝热反应来熔断钢筋.铝热反应方程式如下:2Al+Fe2O3=2Fe+Al2O3,对于该反应,下列说法正确的是( )
| A. | Fe是氧化剂 | B. | Fe2O3被还原 | ||
| C. | A1 发生了还原反应 | D. | Fe2O3失去电子 |
17.能充分说明反应P(g)+Q(g)═R(g)+S(g)在恒温下达到平衡状态的是( )
| A. | 容器内的压强不随时间而变化 | B. | 混合气体的密度不再随时间而变化 | ||
| C. | P和R的生成速率相等 | D. | 容器内P、Q、R、S共存 |
1.氟利昂-122的化学式是CF2Cl2,下面关于氟利昂-122的说法正确的是( )
| A. | 属于正四面体的空间结构 | B. | 对环境无污染 | ||
| C. | 没有同分异构体 | D. | 是甲烷的同系物 |
15. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,(填序号)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填序号)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,(填序号)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填序号)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
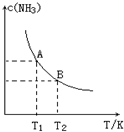 将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.
将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.