题目内容
4.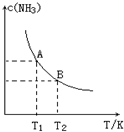 将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.
将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.(1)当温度由T1变化到T2时,平衡常数关系K1>K2(填“>”,“<”或“=”).
(2)温度为T1时,该反应5min达到平衡,这段时间内用N2表示的化学反应速率v(N2)=0.08mol/(L•min).
(3)温度为T1时,该反应的化学平衡常数K1=18.3(小数点后保留一位小数),写出N2和H2反应生成NH3的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-2.5a kJ/mol.
(4)下列措施中能使N2的转化率增大的有BEF.
A.在原容器中再充入l mol N2 B.在原容器中再充入1mol H2
C.在原容器中充入l mol He D.使用更有效的催化剂
E.降低温度 F.将NH3从体系中分离出去.
分析 (1)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(2)将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,温度为T1时平衡混合气体中氨气的体积分数为25%,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
变化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=25%,解得x=0.4,再根据v=$\frac{△c}{△t}$计算v(N2);
(3)化学平衡常数K1=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;计算1mol氮气反应放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(4)使N2的转化率增大,应改变条件使平衡正向移动,但不能只增大氮气浓度,否则氮气转化率为降低.
解答 解:(1)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数关系K1>K2,故答案为:>;
(2)将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,温度为T1时平衡混合气体中氨气的体积分数为25%,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
变化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=25%,解得x=0.4,则v(N2)=$\frac{\frac{0.4mol}{10L}}{5min}$=0.008mol/(L.min),
故答案为:0.008mol/(L.min);
(3)温度为T1时,该反应的化学平衡常数K1=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.0{8}^{2}}{0.06×0.1{8}^{3}}$=18.3;
1mol氮气反应放出的热量为akJ×$\frac{1mol}{0.4mol}$=2.5akJ,反应热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2.5a kJ/mol,
故答案为:18.3;N2(g)+3H2(g)?2NH3(g)△H=-2.5a kJ/mol;
(4)使N2的转化率增大,应改变条件使平衡正向移动,但不能只增大氮气浓度,否则氮气转化率为降低.
A.在原容器中再充入l mol N2,平衡正向移动,但氮气的转化率减低,故A错误;
B.在原容器中再充入1mol H2,平衡正向移动,但氮气的转化率增大,故B正确;
C.在原容器中充入l mol He,恒温恒容下,各组分浓度不变,平衡不移动,氮气转化率不变,故C错误;
D.使用更有效的催化剂,不影响平衡移动,氮气转化率不变,故D错误;
E.正反应为放热反应,降低温度,平衡正向移动,氮气转化率增大,故E正确;
F.将NH3从体系中分离出去,平衡正向移动,氮气转化率增大,故F正确,
故选:BEF.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数等,注意对平衡移动原理的理解掌握.

| A. | 羟基影响了苯环,使苯环上的氢原子变得更活泼 | |
| B. | 苯环影响了羟基,使羟基上的氢原子变得更活泼 | |
| C. | 苯环与羟基相互影响,使羟基上的氢原子变得更活泼 | |
| D. | 苯环与羟基相互影响,使苯环上的氢原子变得更活泼 |
| A. | H+ | B. | Ba2+ | C. | NH4+ | D. | CO32- |
 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法不正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法不正确的是( )| A. | N4晶体属于由非极性键构成的分子晶体 | |
| B. | 氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | |
| C. | lmol N4气体转变为N2气体放出888kJ热量 | |
| D. | N4与N2互为同素异形体 |
| A. | 醋酸溶液加水稀释后,各离子浓度均减小 | |
| B. | 将Na2SO3溶液、FeCl3溶液蒸干均得不到原溶质 | |
| C. | 加热滴有酚酞的CH3COONa溶液,溶液颜色变浅 | |
| D. | 0.1 mol/L Na2CO3溶液中,c(HCO3-)>c(CO32-) |
| A. | 96g | B. | 96g/mol | C. | 98g | D. | 98g/mol |