题目内容
14.已知aRO4x-+bH++cCl-═dR2++5Cl2↑+8H2O,则RO4x-中R的化合价为( )| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
分析 由质量守恒可知b=16,c=10,a=2,d=2,结合电荷守恒计算x,则可确定RO4x-中R的化合价,以此解答该题.
解答 解:对应反应aRO4x-+bH++cCl-═dR2++5Cl2↑+8H2O,由质量守恒可知b=16,c=10,a=2,d=2,结合电荷守恒可知16-2x-10=4,则x=1,则可确定RO4-中R的化合价+7,
故选D.
点评 本题以氧化还原反应为载体考查元素化合价判断,根据电荷守恒、离子中各元素化合价的代数和分析解答即可,侧重考查分析计算能力,题目难度不大.

练习册系列答案
相关题目
4.下列叙述中正确的是( )
| A. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| B. | 煤经气化和液化等物理变化可转化为清洁燃料 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 苯和油脂均不能使酸性髙锰酸钾溶液褪色 |
5.已知E1=134kJ•mol-1、E2=368kJ•mol-1,请参考题中图表,根据要求回答问题:
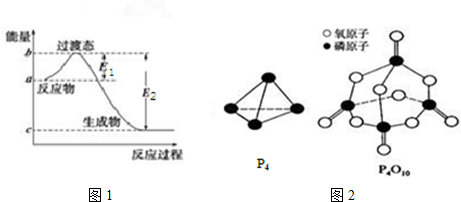
(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为dkJ•mol-1,白磷及其完全燃烧的产物的结构如图2所示,则表中x=$\frac{6a+5c+d-12b}{4}$kJ•mol-1(用含a、b、c、d的代表数式表示).

(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
2.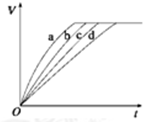 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
19.下列物质中,既含有离子键又含有共价键的是( )
| A. | K2O | B. | CH3COOH | C. | NH4NO3 | D. | H2SO4 |
6.可逆反应:
(Ⅰ)2A(g)+B(g)?2C(g)+Q
(Ⅱ)3A(g)?D(g)+E(g)-Q,
下列条件均能使反应(Ⅰ)、(Ⅱ)中A的转化率增大的是( )
①增大压强 ②升高温度 ③增加A的浓度.
(Ⅰ)2A(g)+B(g)?2C(g)+Q
(Ⅱ)3A(g)?D(g)+E(g)-Q,
下列条件均能使反应(Ⅰ)、(Ⅱ)中A的转化率增大的是( )
①增大压强 ②升高温度 ③增加A的浓度.
| A. | 仅① | B. | ①③ | C. | ①②③ | D. | 都不能 |
3.决定化学反应速率的根本因素是( )
| A. | 合适的催化剂 | B. | 温度和压强 | C. | 反应物的浓度 | D. | 反应物的性质 |
4.我国科学家不久前成功合成了3mm长的管状定向碳纳米管,长度居世界之首,这种碳纤维具有强度高、硬度(抵抗变形能力)高、密度小(只有钢的$\frac{1}{4}$)、熔点高、化学稳定性好等特点,因而被称为“超级纤维”.对碳纤维的下列说法中不正确的是( )
| A. | 它是制造飞机的理想材料 | B. | 它是一种新的碳单质 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |