题目内容
13.若元素X、Y是同主族,X元素最高价氧化物对应水化物的碱性比Y强,下列有关X、Y元素及其单质和化合物的性质判断正确的是( )| A. | 原子半径:X>Y | |
| B. | 失电子能力:X<Y | |
| C. | 对应简单离子的氧化性:X>Y | |
| D. | X元素的单质跟酸反应置换出氢气比Y容易 |
分析 同一主族元素中,原子序数越大,金属性越强,若元素X、Y是同主族,X元素最高价氧化物对应水化物的碱性比Y强,则X的原子序数大于Y,结合元素周期律知识解答.
解答 解:若元素X、Y是同主族,X元素最高价氧化物对应水化物的碱性比Y强,则X的原子序数大于Y,金属性X>Y,
A.同一主族中,原子序数越大,原子半径越大,则原子半径X>Y,故A正确;
B.同一主族中,原子序数越大,金属性越强,失去电子能力越强,则失电子能力:X>Y,故B错误;
C.金属性越强,对应离子的还原性越弱,金属性X>Y,则简单离子的氧化性:X<Y,故C错误;
D.金属性越强,与酸反应置换出氢气越容易,根据分析可知金属性X>Y,则X元素的单质跟酸反应置换出氢气比Y容易,故D正确;
故选AD.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期律的内容为解答关键,注意掌握原子结构与元素周期律的关系及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
3. 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )| A. | 该实验表明化学能可以转化为热能 | |
| B. | NaOH溶液的浓度大于1.00 mol•L-1 | |
| C. | V=50 mL时,混合液呈碱性 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
4.下列物质中原子数最多的是( )
| A. | 4克H2 | B. | 3.01×1023个O2 | C. | 0.8mo1NH3 | D. | 4克NaOH |
1.pH相同的两份溶液(甲:盐酸,乙:醋酸)分别于锌粒反应,若最后锌都完全溶解,且放出气体一样多,那么下列判断不正确的是( )
| A. | 反应开始时速率:甲=乙 | B. | 反应所需时间:乙>甲 | ||
| C. | 参加反应时锌的质量:甲=乙 | D. | 两份酸溶液物质的量浓度:乙>甲 |
8.某元素的原子结构示意图为 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )
 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )| A. | 原子的核内质子数为17 | B. | 原子的核外有3个电子层 | ||
| C. | 原子的最外层电子数为7 | D. | 属于金属元素 |
18.将5.6克不纯的铁与足量稀硫酸反应,生成氢气0.2克.该不纯的铁含有的杂质可能是( )
| A. | 碳和锌 | B. | 铁锈 | C. | 碳和铝 | D. | 碳 |
5.下列电子式书写正确的是( )
| A. | 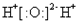 | B. | Cl:Cl | C. | 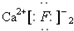 | D. |  |
2.对三联苯是一种有机合成的中间体.工业上合成对三联苯的化学方程式为

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 上述反应属于取代反应 | |
| B. | 对三联苯的一氯取代物有3种 | |
| C. | 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2 | |
| D. | 对三联苯分子中至少有16个原子共平面 |