题目内容
某氢氧化钾样品中含K2CO3 5.0%、H2O 4.2%、KHCO3 1.5%,取a g样品溶于40mL 2mol/L的盐酸后,并用0.5mol/L的KOH溶液中和剩余的酸,最后蒸发所得溶液,得干燥的固体质量为( )
| A、5.96g |
| B、4.68g |
| C、2.15g |
| D、3.78g |
考点:有关混合物反应的计算
专题:计算题
分析:样品加中K2CO3、KHCO3 均与盐酸反应反应生成KCl,剩余的盐酸与KOH反应也生成KCl,故溶液蒸发后剩余固体为KCl,根据氯元素守恒n(KCl)=n(HCl),再根据m=nM计算m(KCl).
解答:
解:样品加中K2CO3、KHCO3 均与盐酸反应反应生成KCl,剩余的盐酸与KOH反应也生成KCl,故溶液蒸发后剩余固体为KCl,根据氯元素守恒n(KCl)=n(HCl)=0.04L×2mol/L=0.08mol,故m(KCl)=0.08mol×74.5g/mol=5.96g,故选A.
点评:本题考查混合物计算,侧重考查发生分析解决问题的能力,关键是判断最终产物的成分,利用守恒法计算,难度中等.

练习册系列答案
相关题目
关于苹果酸(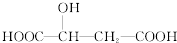 )说法正确的是( )
)说法正确的是( )
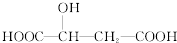 )说法正确的是( )
)说法正确的是( )| A、苹果酸不易溶于水而易溶于有机溶剂 |
| B、和苹果酸具有相同官能团的同分异构体只有1种 |
| C、1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH |
| D、1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下) |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,2.24LCH4所含质子数为0.1NA |
| B、0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C、0.1mol C8H18分子中共价键总数为2.5NA |
| D、100mL 1mol/L醋酸溶液中离子总数为0.2NA |
现有AgNO3、Na2CO3和 Na2SO4三种无色溶液,只用一种试剂,一次区别开,则该试剂是( )
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
如图所示的实验操作中正确的是( )
A、 |
B、 |
C、 |
D、 |
下列说法中正确的是( )
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
已知:250C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是( )
| A、250C 时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B、250C 时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C、250C时,Mg(OH)2固体在20ml0.01mol?L-1氨水中的Ksp比在20mL0.01mol?L-1NH4Cl溶液中的Ksp小 |
| D、250C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
下列说法正确的是( )
| A、制普通玻璃的主要原料是烧碱、石灰石、石英 |
| B、晶体硅可用于制作半导体材料 |
| C、实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 |
| D、光导纤维的主要成份是硅 |
