题目内容
某化合物的结构(键线式)及球棍模型如下.该有机分子的核磁共振波谱图如下(单位是ppm):
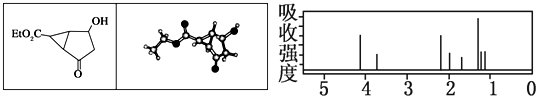
下列关于该有机物的叙述正确的是( )

下列关于该有机物的叙述正确的是( )
| A、右图中最强吸收峰与最弱吸收峰高度比为3:2 |
| B、该有机物分子中含有4个手性碳原子 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应和取代反应,但不能发生还原反应 |
考点:有机物实验式和分子式的确定
专题:有机化学基础
分析:A.观察核磁共振谱图得出信息;
B.根据手性碳原子的概念结合有机物的结构判断;
C.对比键线式和球棍模型可知Et代表的基团;
D.含-OH,且与-OH相连的C的邻位C上含H.
B.根据手性碳原子的概念结合有机物的结构判断;
C.对比键线式和球棍模型可知Et代表的基团;
D.含-OH,且与-OH相连的C的邻位C上含H.
解答:
解:A.该有机物结构不对称,含8种位置的H原子,所以核磁共振波谱图中有8种峰,右图中最强吸收峰与最弱吸收峰高度比为3:1,故A错误;
B.手性碳原子是指同一个碳上连着4个不同的原子或原子团,从结构式可看出有4个这样的原子,分别为和羟基相连的碳、和乙基相连的碳以及和乙基相连碳的相邻两个碳,故B正确;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C错误;
D.含-OH,且与-OH相连的C的邻位C上含H,所以在一定条件下能够发生消去反应、取代反应,有碳氧双键,能发生加成反应,即还原反应,故D错误;
故选B.
B.手性碳原子是指同一个碳上连着4个不同的原子或原子团,从结构式可看出有4个这样的原子,分别为和羟基相连的碳、和乙基相连的碳以及和乙基相连碳的相邻两个碳,故B正确;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C错误;
D.含-OH,且与-OH相连的C的邻位C上含H,所以在一定条件下能够发生消去反应、取代反应,有碳氧双键,能发生加成反应,即还原反应,故D错误;
故选B.
点评:本题考查有机物的结构与性质,注意把握有机物的官能团及性质的关系,明确习题中的相关信息即可解答,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
用下列装置进行实验,设计正确且能达到实验目的是( )
A、 制取少量H2 |
B、 分离Na2CO3溶液和CH3COOC2H5的混合物 |
C、 验证Na和水反应为放热反应 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
下列物质分类的正确组合是( )
| 碱 | 酸 | 盐 | 酸性氧化物 | 碱性氧化物 | |
| A. | Na2CO3 | H2SO4 | NaOH | CO2 | SO2 |
| B. | NaOH | HCl | NaCl | CO | Na2O |
| C | NaOH | CH3COOH | CaF2 | SO2 | CO |
| D. | KOH | HNO3 | CaCO3 | SO3 | CaO |
| A、A | B、B | C、C | D、D |
已知:P4(s、白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol;4P(s、红磷)+5O2(g)═P4O10(s)△H=-2954kJ/mol;那么,1mol白磷转变成相应物质的量红磷时,应是( )
| A、吸收29.2kJ热量 |
| B、放出29.2kJ热量 |
| C、放出7.3kJ热量D.吸收7.3kJ热量 |
| D、101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,反应达到平衡后,改变某一个条件,如图示意图曲线①~⑧中正确的是( )


| A、①⑥⑧ | B、①⑤⑦ |
| C、②③④ | D、③⑥⑦ |
将甲、乙两种金属的性质相比较,能说明甲的金属性比乙强的是( )
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某金属反应时甲原子得电子数目比乙的多.
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某金属反应时甲原子得电子数目比乙的多.
| A、①④ | B、①③ |
| C、①②③ | D、①②③④ |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
下列叙述错误的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A、容器①、②中反应的平衡常数相等 |
| B、平衡时,两个容器中NH3的体积分数相等 |
| C、容器②中达平衡时放出的热量Q=23.15 kJ |
| D、若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ |
下列化学方程式中有一个与其他三个在分类上不同,这个反应是( )
A、3Fe+2O2
| ||||
B、C+CO2
| ||||
C、NH4HCO3
| ||||
| D、Na2CO3+CO2+H2O═2NaHCO3 |