题目内容
将甲、乙两种金属的性质相比较,能说明甲的金属性比乙强的是( )
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某金属反应时甲原子得电子数目比乙的多.
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某金属反应时甲原子得电子数目比乙的多.
| A、①④ | B、①③ |
| C、①②③ | D、①②③④ |
考点:金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:比较元素的金属性,可通过①最高价氧化物的水化物的碱性强弱;②与水或酸反应的剧烈程度;③金属之间的置换反应;④构成原电池的正负极等角度比较.
解答:
解:①甲与水反应比乙与水反应剧烈,金属性越强,与水反应越剧烈,故能说明甲的金属性比乙强,故①正确;
②甲单质能从乙的盐溶液中置换出单质乙,还原性甲>乙,故甲更活泼,金属性更强,故②正确;
③金属性越强,对应最高价氧化物的水化物的碱性强弱,甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强,说明甲的金属性比乙强,故③正确;
④金属性的强弱与失去电子的难易有关,与失去电子的多少无关,如相同物质的量的Al、Na与氯气反应,Al失去电子数目较多,但Na的金属性强,故④错误.
故选:C.
②甲单质能从乙的盐溶液中置换出单质乙,还原性甲>乙,故甲更活泼,金属性更强,故②正确;
③金属性越强,对应最高价氧化物的水化物的碱性强弱,甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强,说明甲的金属性比乙强,故③正确;
④金属性的强弱与失去电子的难易有关,与失去电子的多少无关,如相同物质的量的Al、Na与氯气反应,Al失去电子数目较多,但Na的金属性强,故④错误.
故选:C.
点评:本题考查金属性强弱的比较,题目难度中等,注意比较金属性强弱的角度,注意基础知识的理解掌握.

练习册系列答案
相关题目
下列各有机化合物的命名正确的是( )
| A、CH2═CH-CH═CH2 1,3二丁烯 |
B、 3-丁醇 3-丁醇 |
C、 甲基苯酚 甲基苯酚 |
D、 2-甲基丁烷 2-甲基丁烷 |
在0.5molK2SO4中含有K+数目是( )
| A、3.01×1023 |
| B、6.02×1023 |
| C、0.5 |
| D、1 |
下列离子方程式与所述事实不相符的是( )
| A、向Ba(OH)2稀溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
某化合物的结构(键线式)及球棍模型如下.该有机分子的核磁共振波谱图如下(单位是ppm):
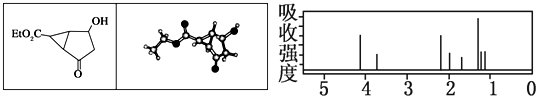
下列关于该有机物的叙述正确的是( )

下列关于该有机物的叙述正确的是( )
| A、右图中最强吸收峰与最弱吸收峰高度比为3:2 |
| B、该有机物分子中含有4个手性碳原子 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应和取代反应,但不能发生还原反应 |
下列各组分子或离子中,中心原子的杂化轨道类型相同的是( )
| A、CO2与NO2 |
| B、PCl3和BF3 |
| C、CO32-与SO32- |
| D、CH4和SO42- |
将1mol X和1mol Y充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(s)+a Q(g).2min达到平衡时生成0.4mol Z,测得Q的浓度为0.2mol/L,下列叙述错误的是( )
| A、增大该体系的压强,平衡不移动,化学平衡常数不变 |
| B、反应速率v(Y)=0.15 mol/(L?min) |
| C、Y的平衡转化率为60% |
| D、增加X,平衡向右移动,X的平衡转化率减小 |
下列关于物质性质与应用的说法正确的是( )
| A、碳具有还原性,高温条件下能将二氧化硅还原为硅 |
| B、二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 |
| C、二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D、二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂 |