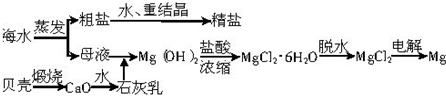
题目内容
C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
(3)①CaCO3和适量HCl溶液反应时,每产生4.4g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 .
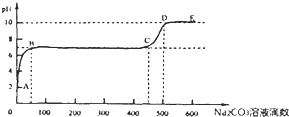
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示,请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式 .

(1)C元素位于元素周期表第
(2)用“大于”“小于”或“等于”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示,请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
考点:同位素及其应用,非金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较,热化学方程式,化学电源新型电池
专题:化学反应中的能量变化,元素周期律与元素周期表专题,电化学专题
分析:(1)C元素位于元素周期表第二周期,第IVA族;
(2)核外电子排布相同的离子,离子核电荷数越大,半径越小;元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;单质的氧化性越强,离子的还原性越弱;同种元素得电子能力相同;
(3)每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ;
(4)燃料电池中,负极上燃料失电子发生氧化反应.
(2)核外电子排布相同的离子,离子核电荷数越大,半径越小;元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;单质的氧化性越强,离子的还原性越弱;同种元素得电子能力相同;
(3)每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ;
(4)燃料电池中,负极上燃料失电子发生氧化反应.
解答:
解:(1)C元素位于元素周期表第二周期,第IVA族,14C可以测定文物年代,故答案为:二;IVA;14C;
(2)N3-、Al3为核外电子排布相同的离子,离子核电荷数越大,半径越小,则N3- 大于Al3+,非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;氧气的氧化性大于硫单质,则O2-小于S2-;同种元素得电子能力相同,故答案为:大于;小于;小于;等于;
(3)①每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ,热化学方程式为:CaCO3(s)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol,故答案为:CaCO3(s)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol;
②由图象可知BC段PH不变,则为CaCl2+Na2CO3=CaCO3↓+2NaCl,其离子方程式为:Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(4)氢氧燃料电池工作时,负极上燃料失电子发生氧化反应,电极反应方程式为H2+2OH--2e-═2H2O,故答案为:H2+2OH--2e-═2H2O.
(2)N3-、Al3为核外电子排布相同的离子,离子核电荷数越大,半径越小,则N3- 大于Al3+,非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;氧气的氧化性大于硫单质,则O2-小于S2-;同种元素得电子能力相同,故答案为:大于;小于;小于;等于;
(3)①每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ,热化学方程式为:CaCO3(s)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol,故答案为:CaCO3(s)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol;
②由图象可知BC段PH不变,则为CaCl2+Na2CO3=CaCO3↓+2NaCl,其离子方程式为:Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(4)氢氧燃料电池工作时,负极上燃料失电子发生氧化反应,电极反应方程式为H2+2OH--2e-═2H2O,故答案为:H2+2OH--2e-═2H2O.
点评:本题考查了元素周期表、元素周期律、热化学方程式、电极反应式等,题目较为综合,是对学生综合能力的考查,难度较大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
某化合物的结构(键线式)及球棍模型如下.该有机分子的核磁共振波谱图如下(单位是ppm):
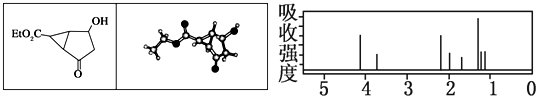
下列关于该有机物的叙述正确的是( )

下列关于该有机物的叙述正确的是( )
| A、右图中最强吸收峰与最弱吸收峰高度比为3:2 |
| B、该有机物分子中含有4个手性碳原子 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应和取代反应,但不能发生还原反应 |
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g)?2SO3(g),这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A、达到平衡时,SO2的浓度与SO3的浓度相等 |
| B、相同状况下,反应2SO3(g)?2SO2(g)+O2(g)是一个吸热反应 |
| C、为了提高SO2转化率,可适当提高O2浓度 |
| D、升高温度,放热反应的速率增大,吸热反应的速率也增大 |
Na2CO3俗名为纯碱,下面对纯碱采用不同分类法进行分类,不正确的是( )
| A、碱 | B、盐 | C、钠盐 | D、碳酸盐 |


 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.