题目内容
15.NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 在精炼铜或电镀铜的过程中,当阳极析出铜64g转移电子数均为2NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 1.0mo1•L-1的Na2CO3溶液中所含阴离子数大于NA个 | |
| D. | 1mol的甲基(-CH3)中所含的电子数为10NA |
分析 A、在电解精炼铜或电镀铜时,阳极上均有铜溶解;
B、求出石墨的物质的量,然后根据1mol石墨形成0.5mol六元环来分析;
C、溶液体积不明确;
D、甲基不显电性.
解答 解:A、在电解精炼铜或电镀铜时,阳极上均有铜溶解,阴极上有铜析出,故A错误;
B、24g石墨的物质的量为2mol,而1mol石墨形成0.5mol六元环,故2mol石墨形成NA个六元环,故B正确;
C、溶液体积不明确,故溶液中的阴离子的个数无法计算,故C错误;
D、甲基不显电性,既没有失电子也没有得电子,故1mol甲基中含9NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.有①甲烷分子;②氨分子;③白磷分子;④氯仿分子;⑤四氯化碳分子;⑥二氧化碳分子.其中不是四面体构型的是( )
| A. | ①③ | B. | ③⑤ | C. | ①⑤ | D. | ②⑥ |
3.下列分子中所有原子都满足最外层8电子稳定结构的是( )
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 二氧化碳(CO2) | D. | 三氟化硼(BF3) |
10.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )
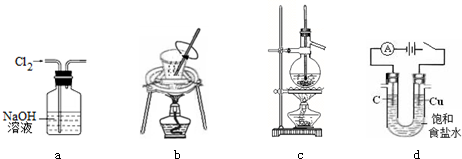

| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置进行从海带中提取碘实验时灼烧海带 | |
| C. | 用图c所示装置分离沸点相差较大的互溶液体混合物 | |
| D. | 用图d所示装置进行电解法制Cl2、H2 |
20.下列化学用语或模型正确的是( )
| A. | 甲烷分子的填充模型: | B. | 氯化氢的电子式: | ||
| C. | 乙烷的结构式:C2H6 | D. | 乙烯的结构简式:CH2CH2 |
7.下列有关有机化合物的认识正确的是( )
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 向蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,加水也不溶解 | |
| C. | 甲烷和氯气混合光照后黄绿色消失,是发生了加成反应 | |
| D. | 纤维素、淀粉都是天然高分子化合物 |
4.下列实验能获得成功的是( )
| A. | 用溴水可鉴别苯、乙醇、苯乙烯 | |
| B. | 加浓溴水,然后过滤可除去苯中的少量乙烯 | |
| C. | 用酸性KMnO4溶液可除去甲烷中的乙烯 | |
| D. | 用新制的Cu(OH)2悬浊液可鉴别乙醇、乙醛、乙酸 |
5.下列溶液中不能溶解新制的氢氧化铝的是( )
| A. | 氨水 | B. | 氢氧化钾溶液 | C. | 硝酸 | D. | 硫酸 |
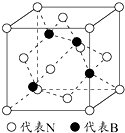 利用所学化学知识解答问题:
利用所学化学知识解答问题: