题目内容
某无色溶液中存在大量NH4+、SO42-、Cl-,该溶液中还可能大量存在的离子是( )
| A、Ba2+ |
| B、OH- |
| C、Cu2+ |
| D、Al3+ |
考点:离子共存问题
专题:
分析:无色溶液说明不含有颜色的离子,离子之间不反应生成气体、沉淀、弱电解质、络合物或发生氧化还原反应、双水解反应的就能共存,据此分析解答.
解答:
解:A.Ba2+、SO42-反应生成硫酸钡白色沉淀,所以不能共存,故A错误;
B.NH4+、OH-反应生成弱电解质一水合氨,所以不能共存,故B错误;
C.Cu2+呈蓝色不符合无色条件,故C错误;
D.NH4+、SO42-、Cl-和Al3+之间不反应且都呈无色,所以这几种离子能共存,故D正确;
故选D.
B.NH4+、OH-反应生成弱电解质一水合氨,所以不能共存,故B错误;
C.Cu2+呈蓝色不符合无色条件,故C错误;
D.NH4+、SO42-、Cl-和Al3+之间不反应且都呈无色,所以这几种离子能共存,故D正确;
故选D.
点评:本题考查离子共存,为高考高频点,明确离子性质及离子共存条件即可解答,知道常见离子颜色,离子共存常常与氧化还原反应、双水解反应、络合反应、pH等联合考查,题目难度不大.

练习册系列答案
相关题目
下列叙述或离子方程式书写正确的是( )
| A、将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ | ||||
| B、向含有Fe2O3悬浊液中通入HI气体:Fe2O3+6H+=2Fe3++3H2O | ||||
C、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| D、等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3?H2O |
我国是一个用碱大国,侯氏制碱法为我们提供了很好的制碱的方法,其基本原理之一是NaCl+CO2+H2O+NH3═NaHCO3+NH4Cl.下列有关说法正确的是( )
| A、向饱和的食盐水中通气体的最合适的方法是先通CO2,再通NH3 |
| B、该反应能发生的原因是NaHCO3的溶解度在几种物质中最小 |
| C、若制得的”碱“中混有少量的NaHCO3,应用过量的NaOH溶液除去 |
| D、用酚酞试液可鉴别制得”碱“液和NaHCO3溶液 |
有标准状况下24mL H2和O2的混合气体,在一定条件下点燃后恢复到原状态仅剩余3mL气体(该气体可使带火星木条复燃),则原混合气体中H2和O2的分子个数之比为( )
| A、1:16 | B、16:1 |
| C、17:7 | D、7:5 |

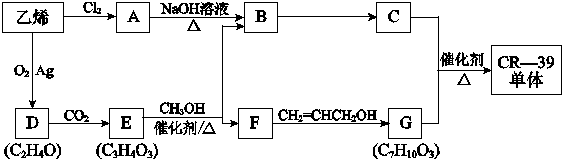
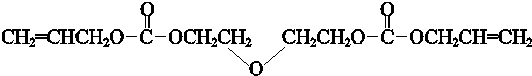
 制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2
制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2