题目内容
2.关于区分等浓度的Na2CO3和NaHCO3两种无色溶液,下列说法不合理的有( )①用pH试纸测定两溶液的pH,pH大的是Na2CO3溶液;
②用两支试管分别取两种溶液少许,滴加几滴酚酞试液,红色深的是Na2CO3溶液;
③用两支试管分别取两种溶液少许加热,有气泡产生的是NaHCO3溶液;
④用两支试管分别取两种溶液少许滴加稀盐酸,首先产生气泡的是NaHCO 3溶液;
⑤用两支试管分别取两种溶液少许滴加Ba (OH)2溶液,立即产生白色沉淀的是Na2CO3溶液;
⑥用两支试管分别取两种溶液少许滴加FeCl3溶液,产生红褐色沉淀和气泡的是NaHCO3溶液.
| A. | 2句 | B. | 3句 | C. | 4句 | D. | 5句 |
分析 鉴别Na2CO3和NaHCO3溶液,应根据二者性质的不同之处进行实验设计,不同之处有:①加入CaCl2溶液只有Na2CO3生成沉淀;②Na2CO3较NaHCO3水解程度大;③NaHCO3与盐酸反应产生气泡速度更快等,据此分析解答.
解答 解:①碳酸钠、碳酸氢钠都是强碱弱酸盐水解呈碱性,同温度相同物质的量浓度碳酸钠、碳酸氢钠溶液中,Na2CO3水解程度大于NaHCO3,所以Na2CO3溶液中氢氧根离子浓度大,pH大,故正确;
②Na2CO3较NaHCO3水解程度大,分别滴加酚酞试液,红色较深的是Na2CO3溶液,故正确;
③NaHCO3溶液加热不分解,无气泡产生,故错误;
④分别滴加HCl溶液,立即有气泡产生的是NaHCO3溶液,涉及反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故正确;
⑤分别滴加少许Ba (OH)2溶液,Na2CO3和Ba (OH)2溶液产生沉淀,化学反应方程式为:Ba (OH)2+Na2CO3═BaCO3↓+2NaOH,但NaHCO3与Ba (OH)2也产生沉淀,化学反应方程式为:Ba (OH)2+NaHCO3═BaCO3↓+NaOH+H2O,故错误;
⑥用两支试管分别取两种溶液少许滴加FeCl3溶液,Na2CO3和NaHCO3都与FeCl3溶液发生双水解产生红褐色沉淀和气泡,故错误;
所以下列说法不合理的有3句.
故选B.
点评 本题考查Na2CO3和NaHCO3性质的异同,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
1.下列有关实验的操作或叙述正确是( )
| A. | 海带中碘元素检验的实验过程是灼烧→溶解→过滤→萃取 | |
| B. | 用容量瓶配制一定物质的量浓度溶液时,加入蒸馏水需要用玻璃棒引流加至刻度线 | |
| C. | 用有机溶剂苯萃取碘水中的碘,分液时,有机层从分液漏斗的下口放出 | |
| D. | 用新制备的Cu(OH)2的悬浊液来鉴别乙醇、乙酸和葡萄糖三种无色溶液 |
13.下列微粒中含有配位键的是( )
①H3O+;②NH4+;③[Cu(H2O)4]2+;④[Fe(SCN)6]3-;⑤CuCl42-;⑥CH4;⑦NH3.
①H3O+;②NH4+;③[Cu(H2O)4]2+;④[Fe(SCN)6]3-;⑤CuCl42-;⑥CH4;⑦NH3.
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ④⑤⑦ | D. | ②④⑥ |
10.C2H5OH、CH4、C3H8、C是常用的燃料,它们每1mol分别完全燃烧时,前三种生成CO2(g)及H2O(l),最后一种生成CO2(g),放出的热量依次为1366.8kJ、890.3kJ、2219.9kJ、393.5kJ.相同质量的这四种燃料,完全燃烧时放出热量最少的是( )
| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
17.如表是元素周期表的一部分,用化学用语回答:
(1)②的元素符号为F.
(2)比较元素③和⑦的原子半径大小:③<⑦(填“>”或“<”).
(3)绘出元素⑤的离子结构示意图 .
.
(4)元素①的氢化物的电子式为 ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ] | ① | ② | ||||
| 三 | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ |
(2)比较元素③和⑦的原子半径大小:③<⑦(填“>”或“<”).
(3)绘出元素⑤的离子结构示意图
 .
.(4)元素①的氢化物的电子式为
 ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
7.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Q>W | |
| B. | X、Y对应的简单离子的氧化性:Xm+>Yn+ | |
| C. | Q和Z所形成的分子空间构型为直线形 | |
| D. | Q和W可形成原子个数比为1:1和2:1的化合物 |
14.下列关于有机物的说法中正确的是( )
| A. | 卤代烷水解时,从氟到碘,由于非金属性依次减弱,所以水解越来越困难 | |
| B. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| C. | 相同碳原子数的多卤代烃,随着卤原子数的增多,密度依次降低 | |
| D. | 常温下,CH3Cl是气体,甲烷的其他3种氯代产物都是液体 |
11.图中各装置,能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列说法不正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸( 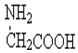 )和丙氨酸( )和丙氨酸( 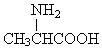 )缩合最多可形成4种二肽(不考虑形成环状) )缩合最多可形成4种二肽(不考虑形成环状) |