题目内容
17.(1)已知2H2+O2═2H2O的反应反应为放热反应,如图能正确表示该反应中能量变化的是A(填编号).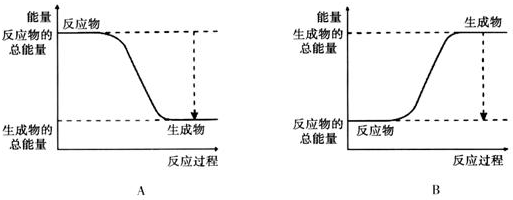
(2)若从断键和成键的角度分析上述反应中能量的变化.化学键的键能如表:
| 化学键 | H-H | O═O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
分析 (1)放热反应中反应物的总能量大于生成物的总能量;
(2)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和.
解答 解:(1)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,故答案为:A;
(2)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即2mol H2在氧气中燃烧生成气态水放出的热量为484kJ,所以生成1mol水放出的热量为 242,故答案为:242.
点评 本题考查较综合,涉及化学键及反应中能量变化为高频考点,有利于基础知识的夯实,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
5.由乙醇制取乙二酸乙二酯( 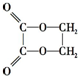 )时最合理的合成路线需经下列反应:
)时最合理的合成路线需经下列反应:
①取代反应
②加成反应
③氧化反应
④还原反应
⑤消去反应
⑥酯化反应
下列有关合成乙二酸乙二酯的过程中反应类型的顺序正确的是( )
 )时最合理的合成路线需经下列反应:
)时最合理的合成路线需经下列反应:①取代反应
②加成反应
③氧化反应
④还原反应
⑤消去反应
⑥酯化反应
下列有关合成乙二酸乙二酯的过程中反应类型的顺序正确的是( )
| A. | ①②③⑤⑥ | B. | ⑤②①③⑥ | C. | ⑥③①②⑤ | D. | ①②⑤③⑥ |
12.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 还原性 B>A>D>C |
2.化学上将质量数相同而质子数不同的原子称为同量素,如40K和40Ca.下列关于40K和40Ca的叙述中正确的是( )
| A. | 40K和40Ca 具有相同的中子数 | |
| B. | 40K+和40Ca2+ 具有相同的电子层结构 | |
| C. | 39K和40Ca互为同位素 | |
| D. | 40K的原子半径小于40Ca 的原子半径 |
9.下列反应,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | C6H6十Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH3+H2O |
 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分. )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: