题目内容
2. 通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.
通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.(1)恒容密闭容器中,将水蒸气通过红热的炭,产生水煤气.反应为C(s)+H2O(g)?CO(g)+H2(g),除升高温度、使用催化剂外,能够使该反应速率增大的措施有增大H2O(g)的浓度.
(2)将不同量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中,进行下列反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO(g) | H2 | CO(g) | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 1.5 | 2 |
| 3 | 2 | 4 | 1.0 | n | t | |
②实验2中,v(CO2)=0.125mol•L-1•min-1,n=3;
③实验2和实验3中CO的转化率关系为:前者等于后者(填“大于”、“等于”、“小于”).
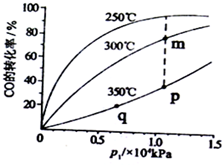
(3)工业上用CO(g)+2H2(g)?CH3OH(g)合成(CH3OH)具有重要意义.把一定物质的量的反应物投料于一恒容容器中,测得不同温度下CO转化率与温度和压强的关系,根据如图可判定:
①m、p、q三点化学平衡常数Km、Kp、Kq的大小关系为Km>Kp=Kq.
②实际生产条件控制250℃,1.3×lO4Pa左右,选择此压强的理由是在250℃,1.3×lO4Pa时,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失.
分析 (1)根据影响化学反应速率的因素分析;
(2)①根据温度升高化学平衡向着吸热方向移动,结合表中数据可得;
②根据v=$\frac{△c}{△t}$计算反应速率,实验3与实验2为等效平衡,实验3是实验2投入量的两倍,平衡时各物质的含量也为实验2的两倍;
③实验3与实验2为等效平衡,转化率相等;
(3)①根据温度对化学平衡的影响结合图表,分析高反应的△H,再根据化学平衡常数与温度有关可得;
②根据物质转化率判断,转化率越大,条件越合适.
解答 解:(1)增大物质浓度可加快反应速率,则可以增大H2O(g)的浓度;
故答案为:增大H2O(g)的浓度;
(2)①由图象可知,实验1和实验3投入量相同,实验3的温度较高,平衡时氢气的量较少,说明平衡逆向移动,则该反应是个放热反应,△H<0;
故答案为:<;
②到容积为2L的恒容密闭容器中,实验2中,反应2min到达平衡,平衡时氢气的物质的量为0.5mol,则二氧化碳也为0.5mol,则v(CO2)=$\frac{0.5mol÷2L}{2min}$=0.125mol•L-1•min-1;该反应是个气体体积不变的反应,加压,平衡不移动,实验3是实验2投入量的两倍,互为等效平衡,平衡是各物质的物质的量也为实验2的两倍,则n=3;
故答案为:0.125mol•L-1•min-1;3;
③实验2和实验3为等效平衡,则物质的转化率相等;
故答案为:等于;
(3)①由图象可知,温度越高,该反应CO的转化率越小,说明温度升高,反应向着逆方向移动,即该反应是个放热反应,而K与温度有关,对于放热反应,温度升高,K减小,m点温度较低,说明Km比p、q两点大,p、q两点温度相同,K相同,故Km>Kp=Kq;
故答案为:Km>Kp=Kq;
②由图象可知:在250℃,1.3×lO4Pa时,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失;
故答案为:在250℃,1.3×lO4Pa时,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失.
点评 本题考查了化学平衡的有关计算和影响化学平衡的因素,题目难度不大,是高考常见类型,注意掌握基础和对题目图象的理解.

①取少量溶液加入过量的Ba(OH)2溶液并加热,生成4.30g白色沉淀和0.51g刺激性气味气体放出;
②取①中上层清液,先加硝酸,再加入一定量的硝酸银溶液,生成1.435g沉淀;
③取①中固体加入过量的盐酸,沉淀剩余2.33g
下列关于该溶液的说法中一定正确的是( )
| A. | 该溶液中一定含有SO42-、NH4+、CO32-、Cl-等离子 | |
| B. | 该溶液中至少含有0.23g Na+ | |
| C. | 该溶液中可能含有Mg2+和Cl- | |
| D. | 该溶液中含有0.355g Cl- |
| A. | SiO2(CaCO3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | FeCl2溶液(FeCl3) |
| A. | 0.5mol | B. | 0.55mol | C. | 1mol | D. | 2mol |
| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
| A. | 1与7 | B. | 1与8 | C. | 3与7 | D. | 7与1 |
| A. | K+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |