题目内容
7.随着社会的发展,人们日益重视环境问题,下列做法或说法不正确的是( )| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
分析 A.焚烧秸秆可导致环境污染;
B.含磷洗衣粉可导致水体污染;
C.汽车尾气含有CO、NO等污染性气体;
D.难以降解的高分子材料导致白色污染.
解答 解:A.焚烧秸秆产生大量浓烟,可导致环境污染,故A错误;
B.含磷洗衣粉可导致水体污染,则推广使用无磷洗衣粉,以减少水体富营养化,减少水体污染,故B正确;
C.汽车尾气含有CO、NO等污染性气体,改进汽车尾气净化技术,可使有害气体生成氮气和二氧化碳,故C正确;
D.难以降解的高分子材料导致白色污染,则研发可降解高分子材料,减少“白色污染”,故D正确.
故选A.
点评 本题考查化学与环境污染,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,树立环保意识,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列溶液中粒子物质的量浓度的关系正确的是( )
| A. | pH相同的①NH4Cl②NH4Al(SO4)3③NH4HSO3,三种溶液中的c(NH4+):①<②<③ | |
| B. | 20mL0.1mol/L的CH3COONa溶液与10mL0.1mol/L的HCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH4COOH)>c(H+) | |
| C. | 0.1mol/L的NaHCO3溶液与0.1mol/L的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
4.下列说法中正确的是( )
| A. | 足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成NaOH | |
| B. | 足量的MnO2与含4molHCl的浓盐酸加热充分反应,产生的Cl2必为1mol | |
| C. | 含2molHCl的某盐酸滴入足量的碳酸钠溶液中充分反应后,得到CO2气体必为1mol | |
| D. | 过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠 |
1.下列物质制备的方程式正确的是( )
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H2O+CaO═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:3Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O |
2. 通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.
通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.
(1)恒容密闭容器中,将水蒸气通过红热的炭,产生水煤气.反应为C(s)+H2O(g)?CO(g)+H2(g),除升高温度、使用催化剂外,能够使该反应速率增大的措施有增大H2O(g)的浓度.
(2)将不同量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中,进行下列反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
①反应CO(g)+H2O?CO2(g)+H2(g)的△H<0(填“>”、“=”、“<”).
②实验2中,v(CO2)=0.125mol•L-1•min-1,n=3;
③实验2和实验3中CO的转化率关系为:前者等于后者(填“大于”、“等于”、“小于”).
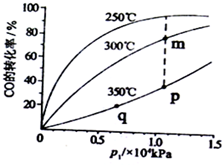
(3)工业上用CO(g)+2H2(g)?CH3OH(g)合成(CH3OH)具有重要意义.把一定物质的量的反应物投料于一恒容容器中,测得不同温度下CO转化率与温度和压强的关系,根据如图可判定:
①m、p、q三点化学平衡常数Km、Kp、Kq的大小关系为Km>Kp=Kq.
②实际生产条件控制250℃,1.3×lO4Pa左右,选择此压强的理由是在250℃,1.3×lO4Pa时,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失.
 通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.
通过化学加工使煤转化为气体、液体、固体燃料,工业上用CO和H2合成CH3OH,请回答下列问题.(1)恒容密闭容器中,将水蒸气通过红热的炭,产生水煤气.反应为C(s)+H2O(g)?CO(g)+H2(g),除升高温度、使用催化剂外,能够使该反应速率增大的措施有增大H2O(g)的浓度.
(2)将不同量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中,进行下列反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO(g) | H2 | CO(g) | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 1.5 | 2 |
| 3 | 2 | 4 | 1.0 | n | t | |
②实验2中,v(CO2)=0.125mol•L-1•min-1,n=3;
③实验2和实验3中CO的转化率关系为:前者等于后者(填“大于”、“等于”、“小于”).
(3)工业上用CO(g)+2H2(g)?CH3OH(g)合成(CH3OH)具有重要意义.把一定物质的量的反应物投料于一恒容容器中,测得不同温度下CO转化率与温度和压强的关系,根据如图可判定:
①m、p、q三点化学平衡常数Km、Kp、Kq的大小关系为Km>Kp=Kq.
②实际生产条件控制250℃,1.3×lO4Pa左右,选择此压强的理由是在250℃,1.3×lO4Pa时,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失.
17.下列分子中,中心原子采用sp3等性杂化的是( )
| A. | H2O | B. | NH3 | C. | PH3 | D. | CH4 |