题目内容
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1.01×105Pa,20℃时48g O3含有的原子数为3NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 | |
| D. | 等质量钠,在足量氧气中加热充分反应比在足量氧气(常温)中充分反应失去的电子多 |
分析 A、臭氧由氧原子构成,故A正确;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、标况下水为液态;
D、钠的质量相等,则物质的量相等,而钠无论反应后产物是什么,钠元素均变为+1价.
解答 解:A、48g臭氧中含有的氧原子的物质的量为n=$\frac{48g}{16g/mol}$=3mol,个数为3NA个,故A正确;
B、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含1mol阴离子即NA个,故B错误;
C、标况下水为液态,而氧气和HCl为气体,故相同体积的氧气、HCl和水的物质的量不同,故C错误;
D、钠的质量相等,则物质的量相等,而钠无论反应后产物是什么,钠元素均变为+1价,即钠失去的电子的个数均相同,与产物无关,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、Fe2+、H+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
7.某溶液中由水电离产生的C(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A. | KOH | B. | Na2CO3 | C. | HClO4 | D. | MgSO4 |
4.物质的体积一定是22.4L的是( )
| A. | 1 mol水蒸汽 | B. | 标准状况下1 mol CCl4 | ||
| C. | 标准状况下44 g二氧化碳 | D. | 0℃、202 kPa时2 g氢气 |
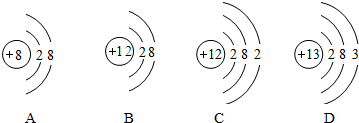
1.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
 现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).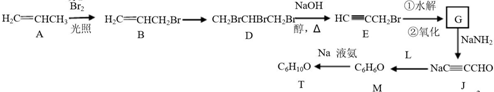
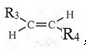 ,则T的结构简式为
,则T的结构简式为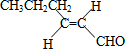 .
.