题目内容
7.某溶液中由水电离产生的C(H+)=1×10-10mol/L,该溶液的溶质不可能是( )| A. | KOH | B. | Na2CO3 | C. | HClO4 | D. | MgSO4 |
分析 常温下,水的离子积为1×10-14,由水电离产生的c(H+)等于10-10mol/L,说明该溶液中的溶质抑制了水的电离,该溶液为酸性或者碱性溶液,据此进行判断.
解答 解:由水电离产生的c(H+)等于10-10mol/L,说明溶液中的溶质抑制了水的电离,
KOH、HClO4都能电离出氢氧根离子或氢离子,抑制水的电离;而Na2CO3电离出的碳酸根离子结合水电离的氢离子,促进了水的电离,水的电离程度增大,故该溶液的溶质不可能是Na2CO3,硫酸镁是强酸弱碱盐,镁离子水解而促进水电离,故不可能是硫酸镁,
故选BD.
点评 本题考查水的电离及其影响因素,难度不大.注意酸碱溶液抑制水的电离,含有弱酸根或弱碱根离子的盐溶液促进水的电离.

练习册系列答案
相关题目
2.下列反应的离子方程式书写正确的是( )
| A. | 向四氧化三铁中加入稀硫酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2至沉淀质量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4+2H2O | |
| C. | 向CuSO4溶液中加入金属钠:2Na+Cu2+═2Na ++Cu | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.01×105Pa,20℃时48g O3含有的原子数为3NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 | |
| D. | 等质量钠,在足量氧气中加热充分反应比在足量氧气(常温)中充分反应失去的电子多 |
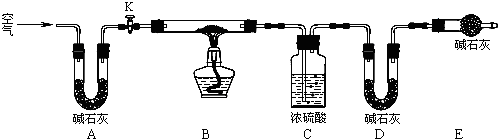
 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
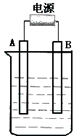
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.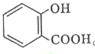 的名称为:2-羟基苯甲酸;在核磁共振氢谱中会出现6组峰;写出其与KHCO3溶液反应的化学方程式:
的名称为:2-羟基苯甲酸;在核磁共振氢谱中会出现6组峰;写出其与KHCO3溶液反应的化学方程式: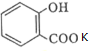 +CO2↑+H2O.
+CO2↑+H2O.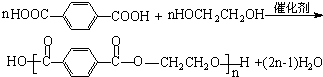 .
.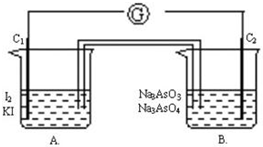 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.