题目内容
1.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述不正确的是( )| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
分析 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,据此分析.
解答 解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,
A.X是C元素,Y是O元素,含有碳氧元素的化合物有一氧化碳和二氧化碳,故A正确;
B.原子的电子层数越多,其原子半径越大,同一周期中,元素的原子半径随着原子序数的增大而减小,C、O元素位于第二周期,Na、Cl元素位于第三周期,且O元素的原子序数大于C、Cl的原子序数大于Na,所以原子半径大小顺序是rz>rR>rx>ry,故B正确;
C.X、Z分别与R形成的化合物分别是CCl4、NaCl,四氯化碳中只含共价键,氯化钠中只含离子键,故C正确;
D.Y、Z、R分别是O、Na、Cl元素,含有三种元素的化合物有NaClO、NaClO2、NaClO3、NaClO4等,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,侧重于学生的分析能力的考查,正确推断元素是解本题关键,结合元素周期律来分析解答,易错选项是D,总结含有O、Na、Cl元素的化合物,难度中等.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.01×105Pa,20℃时48g O3含有的原子数为3NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 | |
| D. | 等质量钠,在足量氧气中加热充分反应比在足量氧气(常温)中充分反应失去的电子多 |
9.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,0.1NA个水分子所占的体积约是2.24 L | |
| B. | 常温常压下,11.2 L CO2中含有11NA个电子 | |
| C. | CH4的摩尔质量和NA个甲烷分子的质量相等 | |
| D. | 常温下,64gSO2气体中含有的原子数为3NA |
6.化学叙述中错误的是( )
| A. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| B. | 金属钠着火时不能使用泡沫灭火器灭火 | |
| C. | 因为NH4Cl受热易分解,实验室应保存在棕色试剂瓶中 | |
| D. | 铁粉作食品袋内的脱氧剂,起还原作用 |
13.能正确表示下列反应的离子方程式的是( )
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
10.下列除杂质(括号内为杂质)的方法正确的是( )
| A. | CO2(CO):点燃 | |
| B. | 硝酸钾(氯化钠):浓溶液降温结晶 | |
| C. | MgSO4(MgCl2):蒸干、灼烧 | |
| D. | 乙酸(乙醛):加新制氢氧化铜浊液加热,过滤 |
11.用如图所示装置进行实验,下列对实验现象的解释不合理的是( )
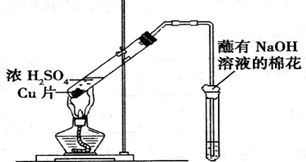

| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
 如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.
如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.