题目内容
16.某研究性小组分别设计了如图1-甲、乙、丙三套实验装置制取乙酸乙酯.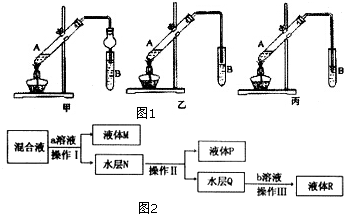
(1)在A试管中加入反应试剂的顺序依次是乙醇、浓硫酸、乙酸(填物质名称).
(2)甲、乙、丙三套装置中,不宜选用的装置是丙(甲、乙、丙).
(3)若E中含有较多的乙醇、乙酸,某同学设计如图2流程来分离各物质:操作 I需要将混合液转移到分液漏斗中进行;操作 II的名称是蒸馏;b物质是硫酸.
分析 (1)制取乙酸乙酯除了反应物乙醇和乙酸外,还需浓硫酸作催化剂和吸水剂,依据溶液密度大小判断加入试剂的顺序;
(2)长导管不能伸到B试管液面下,防止造成溶液倒吸入加热反应物的试管中;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,降低乙酸乙酯溶解度,易于分层,利用萃取分液的方法分离酯,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质.
解答 解:(1)制取乙酸乙酯需浓硫酸作催化剂,A试管中的液态物质有乙酸、乙醇和浓硫酸,加入试剂应先加入密度小的再加入密度大的试剂,在A试管中混合乙醇和浓硫酸的操作是:先向试管A中加入乙醇,然后缓慢的向试管注入浓硫酸,边加边振荡试管,最后加入乙酸,
故答案为:乙醇、浓硫酸、乙酸;
(2)长导管不能伸到B试管液面下,防止B试管中溶液倒吸入A试管中,丙装置B试管中导管伸入液面下,容易发生倒吸,
故答案为:丙;
(3)操作Ⅰ需要将混合液转移到分液漏斗中萃取分液,操作Ⅱ是蒸馏得到乙醇,水层为乙酸钠,加入硫酸溶液分液得到乙酸,蒸馏得到乙酸,
故答案为:分液漏斗;蒸馏;硫酸.
点评 本题考查了乙酸乙酯的制取,题目难度中等,注意掌握乙酸乙酯的制取原理及装置选择,明确反应中饱和碳酸钠溶液的作用及吸收乙酸乙酯的导管的正确处理方法.

练习册系列答案
相关题目
2.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的c(H+)=1×10-3 mol•L-1 |
4.工业制硝酸的主要反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H
(1)已知氢气的燃烧热为△H=-285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=-1168.8kJ/mol.
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①反应在第2min到第4min时,O2的平均反应速率为0.1875mol/(L•min).
②反应在第6min时改变了条件,改变的条件可能是B(填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)?4NO(g)+6H2O(g)达到平衡状态的是ABE(填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
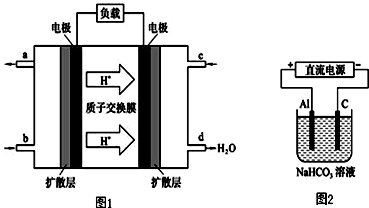
(3)某研究所组装的CH2=CH2-O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为C2H4.
②该电池负极的电极反应式为:C2H4-12e-+4H2O=2CO2+12H+.
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑(用相关的离子方程式表示).
(1)已知氢气的燃烧热为△H=-285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=-1168.8kJ/mol.
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
②反应在第6min时改变了条件,改变的条件可能是B(填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)?4NO(g)+6H2O(g)达到平衡状态的是ABE(填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH2=CH2-O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为C2H4.
②该电池负极的电极反应式为:C2H4-12e-+4H2O=2CO2+12H+.
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑(用相关的离子方程式表示).

11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 CH3COONa溶液:H+、Al3+、Cl-、NO3- |
5.在相同温度时,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数据中,前者大于后者的是( )
①H+的物质的量 ②电离程度 ③中和时所需氢氧化钠溶液的量 ④醋酸的物质的量.
①H+的物质的量 ②电离程度 ③中和时所需氢氧化钠溶液的量 ④醋酸的物质的量.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
6.下列叙述正确的是( )
| A. | H2在Cl2中剧烈燃烧,发出黄色火焰,冒白烟 | |
| B. | SiO2的化学性质不活泼,不与任何酸发生反应 | |
| C. | 常温下,铝、铁遇浓硫酸会发生钝化反应 | |
| D. | 将氯气通入紫色石蕊试液中一些时间后,溶液变红 |
 .
.