题目内容
反应:N2(g)+3H2(g)?2NH3(g)△H<0.在等容条件下进行.体系中各物质浓度随时间变化的曲线如图1所示,回答问题:
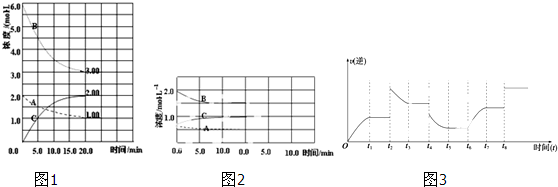
(1)图1中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)图1是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在图2中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可.曲线上必须标出N2、H2、NH3).
(3)若该反应的逆反应速率与时间的关系如图3所示:反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、
t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”…?等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动.

(1)图1中B为
(2)图1是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在图2中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可.曲线上必须标出N2、H2、NH3).
(3)若该反应的逆反应速率与时间的关系如图3所示:反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、
t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”…?等);t2时
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据反应的化学计量数可知,变化量最大的是氢气;根据图象中的浓度变化及时间计算出用H2的浓度变化表示的化学反应平均速率;
(2)达到平衡后,将容器的体积扩大一倍,改变条件的瞬间,各组分的浓度变为原来的二分之一,容器体积增大,压强降低平衡向体积增大的方向移动,即逆向移动,但增大的物质的量浓度小于原平衡时浓度,同时注意各组分物质的量浓度变化量之比等于化学计量数之比,据此作图;
(3)该反应的反应物气体的体积小于生成物气体的体积,增大压强,平衡向正反应方向移动,正反应为放热反应,升高温度平衡向逆反应方向移动,结合逆反应速率的变化解答该题.
(2)达到平衡后,将容器的体积扩大一倍,改变条件的瞬间,各组分的浓度变为原来的二分之一,容器体积增大,压强降低平衡向体积增大的方向移动,即逆向移动,但增大的物质的量浓度小于原平衡时浓度,同时注意各组分物质的量浓度变化量之比等于化学计量数之比,据此作图;
(3)该反应的反应物气体的体积小于生成物气体的体积,增大压强,平衡向正反应方向移动,正反应为放热反应,升高温度平衡向逆反应方向移动,结合逆反应速率的变化解答该题.
解答:
解:(1)据反应的化学计量数可知,变化量最大的是氢气,v(H2)=
mol?L-1?min-1=0.15mol?L-1?min-1,故答案为:H2;0.15mol?L-1?min-1;
(2)达到平衡后,将容器的体积扩大一倍,改变条件的瞬间,各组分的浓度变为原来的二分之一,容器体积增大,压强降低平衡向体积增大的方向移动,即逆向移动,但增大的物质的量浓度小于原平衡时浓度,同时注意各组分物质的量浓度变化量之比等于化学计量数之比,由此可得图为: ,故答案为:
,故答案为: ;
;
(3)t2时逆反应速率增大,至t3时逐渐减小,平衡向逆反应方向移动,应是升高温度,t6时逆反应速率逐渐增大,平衡向正反应方向移动,应是增加反应物的浓度,
t4时逆反应速率减小,至t5时逐渐减小,反应向逆反应方向移动,故答案为:升温;增大N2或H2浓度; 逆.
| 6.0-3.0 |
| 20 |
(2)达到平衡后,将容器的体积扩大一倍,改变条件的瞬间,各组分的浓度变为原来的二分之一,容器体积增大,压强降低平衡向体积增大的方向移动,即逆向移动,但增大的物质的量浓度小于原平衡时浓度,同时注意各组分物质的量浓度变化量之比等于化学计量数之比,由此可得图为:
 ,故答案为:
,故答案为: ;
;(3)t2时逆反应速率增大,至t3时逐渐减小,平衡向逆反应方向移动,应是升高温度,t6时逆反应速率逐渐增大,平衡向正反应方向移动,应是增加反应物的浓度,
t4时逆反应速率减小,至t5时逐渐减小,反应向逆反应方向移动,故答案为:升温;增大N2或H2浓度; 逆.
点评:本题综合考查化学反应速率和化学平衡的移动及影响因素,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握反应的特征,结合图象的曲线变化解答该题.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目