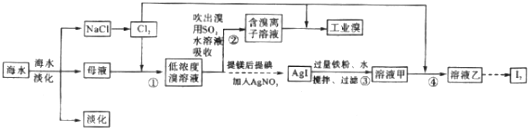
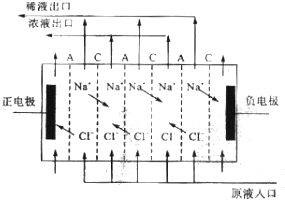
题目内容
2.向一个40.2g的干燥烧杯中加入Na2CO3和NaCl固体混合物,再次称量烧杯的质量为73.1g,然后向其中加入326.9g稀盐酸恰好反应,待反应完全后得到室温下的无色透明溶液,再次称量烧杯的质量为391.2g.(假设二氧化碳在水中的溶解忽略不计)(1)原混合物的质量为32.9g,其中Na2CO3的质量为21.2g.
(2)反应后所得溶液中溶质的质量分数为10%.
分析 (1)根据“烧杯质量+混合物质量=73.1g”计算;
加入盐酸发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,减少的质量为生成二氧化碳的质量,结合方程式计算碳酸钠的质量;
(2)最终得到NaCl溶液,根据钠离子守恒计算最终溶液中NaCl的质量,最终溶液质量=326.9g+固体混合物质量-生成二氧化碳的质量,结合质量分数定义计算.
解答 解:(1)固体混合物质量=73.1g-40.2g=32.9g,
反应生成二氧化碳质量为73.1g+326.9g-391.2g=8.8g
设混合物中碳酸钠的质量为m,则:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
m 8.8g
所以m=$\frac{8.8g×106}{44}$=21.2g
故答案为:32.9;21.2;
(2)原混合物中碳酸钠质量为21.2g,其物质的量为$\frac{21.2g}{106g/mol}$=0.2mol,
原混合物中NaCl为32.9-21.2g=11.7g,其物质的量$\frac{11.7g}{58.5g/mol}$=0.2mol,
最终得到NaCl溶液,根据钠离子守恒,最终溶液中NaCl的质量为(0.2mol×2+0.2mol)×58.5g/mol=35.1g,
最终溶液质量=326.9g+32.9g-8.8g=351g
故最终溶液中NaCl的质量分数为$\frac{35.1g}{351g}$×100%=10%,
故答案为:10%.
点评 本题考查混合物有关计算,涉及方程式计算、溶液质量分数计算,关键是计算二氧化碳与最终溶液质量,有利于培养学生的分析计算能力.

 应用题作业本系列答案
应用题作业本系列答案| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
| A. | 每个分子中都含有氮分子 | B. | 每个分子中的氮原子个数相等 | ||
| C. | 每种物质中氮元素的质量分数相同 | D. | 都属于氧化物 |
| A. | 除去N2中的少量O2:通过灼热的铜网,收集气体 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 | |
| C. | 除去FeCl3溶液中的少量FeCl2:加入足量铁屑,充分反应后过滤 | |
| D. | 除去NaCl溶液中的少量AlCl3:加入适量氨水,过滤 |
| A. | 液态氮 | B. | 氯化钠晶体 | C. | 液态汞 | D. | 金刚石 |
| A. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| B. | pH=12的溶液中 NO3-、I-、Na+ | |
| C. | NaHS溶液中 SO42-、K+、Cl-、Al3+ | |
| D. | 使甲基橙变红的溶液中 C6H5O-、K+、SO42-、Br- |
| A. | 含有0.6mol Ca2+ | B. | 含有0.3mol Cl- | ||
| C. | n(Na+):n(OH-)=1:5 | D. | 所含元素中钙元素的质量很大 |