题目内容
13.关于N2、N2O、N2O5的叙述,正确的是( )| A. | 每个分子中都含有氮分子 | B. | 每个分子中的氮原子个数相等 | ||
| C. | 每种物质中氮元素的质量分数相同 | D. | 都属于氧化物 |
分析 A.只有氮气由氮分子构成;
B.1个N2、N2O、N2O5中均含2个N原子;
C.氮气中N元素质量分数为100%,而N2O、N2O5中均含O元素;
D.氧化物一定含两种元素、且含氧元素.
解答 解:A.只有氮气由氮分子构成,而N2O、N2O5不含氮分子,故A错误;
B.1个N2、N2O、N2O5中均含2个N原子,则每个分子中的氮原子个数相等,故B正确;
C.氮气中N元素质量分数为100%,而N2O、N2O5中均含O元素,含O原子越多时N的质量分数越低,则每种物质中氮元素的质量分数不相同,故C错误;
D.氧化物一定含两种元素、且含氧元素,则氮气为单质,只有N2O、N2O5为氧化物,故D错误;
故选B.
点评 本题考查含氮物质,为高频考点,把握物质的组成、构成、氧化物及质量分数为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.将N2和O2混合气体置于一个密闭容器中,经电火花放电后,恢复到原来的温度和压强,发现气体体积无变化,则原来混合气体中N2和O2的体积比是( )
| A. | 1:1 | B. | <1:1 | C. | ≥1:1 | D. | 任意比 |
4.室温下,有两种溶液:①0.01mol•L-1 NH3•H2O 溶液、②0.01mol•L-1 NH4Cl 溶液,下列操作可以使两种溶液中 c(NH4+)都增大的是( )
| A. | 通入少量 HCl 气体 | B. | 加入少量 NaOH 固体 | ||
| C. | 加入少量 H2O | D. | 适当升高温度 |
1.100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠溶液 | B. | 硫酸氢钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
8.下列关于实验操作的方法正确的是( )
| A. | 将金属钠在研体中研成粉末,使钠与水反应的实验更安全 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 分液时,分液漏斗内的上层液体应由上口倒出 | |
| D. | 用滴定管取液时,开始和最后读数时均俯视,则量取的体积准确 |
18.化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:
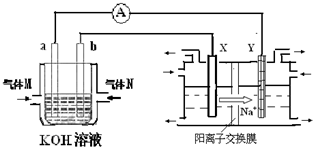
(2)氢氧燃料电池中,a电极为电池的是负极(填“正极”或“负极”),气体M的分子式H2 ,a电极上发生的电极反应式为:H2+OH--2e-=2H2O.
(3)若图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为mol.(保留小数点后2位)
Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:4.14
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ•mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是③④.
①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为27.7kJ.
②0~1小时内N2的平均反应速率0.05mol•L-1•h-1.
③此条件下该反应的化学平衡常数K═0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向方向移动正反应(填“正反应”或“逆反应”或“不移动”.)
Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:

(2)氢氧燃料电池中,a电极为电池的是负极(填“正极”或“负极”),气体M的分子式H2 ,a电极上发生的电极反应式为:H2+OH--2e-=2H2O.
(3)若图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为mol.(保留小数点后2位)
Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:4.14
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ•mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是③④.
①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
| 时间(h) 物质的量/(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为27.7kJ.
②0~1小时内N2的平均反应速率0.05mol•L-1•h-1.
③此条件下该反应的化学平衡常数K═0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向方向移动正反应(填“正反应”或“逆反应”或“不移动”.)