题目内容
7.填写下列空白:(1)写出表示含有6个质子、8个中子的原子的化学符号614C:.
(2)周期表中位于第8纵行的铁元素属于第ⅤⅢ族.
(3)周期表中最活泼金属元素位于第1纵行.
(4)原子种类由决定质子和中子
(5)1~18号元素的化合价主要由最外层电子数决定.
分析 (1)含有6个质子、8个中子的原子为C,其质量数为14;
(2)周期表中8、9、10三个纵行为ⅤⅢ族;
(3)周期表中最活泼金属元素为第ⅠA族;
(4)决定原子种类的微粒是质子和中子;
(5)1~18号元素的化合价主要由最外层电子数,以此来解答.
解答 解:(1)含有6个质子、8个中子的原子为C,其质量数为14,原子的化学符号为614C,故答案为:614C;
(2)周期表中8、9、10三个纵行为ⅤⅢ族,则周期表中位于第8纵行的铁元素属于第ⅤⅢ族,故答案为:ⅤⅢ;
(3)周期表中最活泼金属元素为第ⅠA族,则最活泼金属元素位于第1纵行,故答案为:1;
(4)决定原子种类的微粒是质子和中子,故答案为:质子和中子;
(5)1~18号元素的化合价主要由最外层电子数,故答案为:最外层电子数.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表结构及元素的位置、元素的种类为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
17.依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
| A. | 卤素单质 Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物 NH3、H2O、HF 的稳定性 | |
| C. | 碱金属单质 Li、Na、K 与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al 分别与足量盐酸反应时失电子数的多少 |
18.化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:
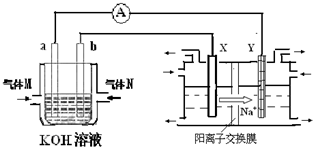
(2)氢氧燃料电池中,a电极为电池的是负极(填“正极”或“负极”),气体M的分子式H2 ,a电极上发生的电极反应式为:H2+OH--2e-=2H2O.
(3)若图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为mol.(保留小数点后2位)
Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:4.14
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ•mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是③④.
①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为27.7kJ.
②0~1小时内N2的平均反应速率0.05mol•L-1•h-1.
③此条件下该反应的化学平衡常数K═0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向方向移动正反应(填“正反应”或“逆反应”或“不移动”.)
Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:

(2)氢氧燃料电池中,a电极为电池的是负极(填“正极”或“负极”),气体M的分子式H2 ,a电极上发生的电极反应式为:H2+OH--2e-=2H2O.
(3)若图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为mol.(保留小数点后2位)
Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:4.14
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ•mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是③④.
①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
| 时间(h) 物质的量/(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为27.7kJ.
②0~1小时内N2的平均反应速率0.05mol•L-1•h-1.
③此条件下该反应的化学平衡常数K═0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向方向移动正反应(填“正反应”或“逆反应”或“不移动”.)
16.下列有关氯元素单质及其化合物性质的说法正确的是.
| A. | 液氯是纯净物,氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 | |
| D. | 不能用pH试纸测定氯水的pH |
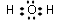 .
.