题目内容
5.下列事实能用勒夏特列原理解释的是( )| A. | 由H2、I2、HI组成的平衡体系加压后颜色变深 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 使用催化剂可加快SO2转化为SO3的速率 | |
| D. | 将木炭粉碎后与O2反应,速率更快 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故A不选;
B、Cl2+H2O?HCl+HClO,次氯酸见光分解,平衡正向移动,氯气浓度减小,颜色变浅,能用勒夏特列原理解释,故B选;
C、催化剂不影响平衡移动只能够加快化学反应速率,所以不能用勒夏特列原理解释,故C不选;
D、将木炭粉碎后燃烧更充分,且能加快燃烧速率是利用增大接触面积,增大反应速率,和化学平衡无关,不能用勒夏特列原理解释,故D不选.
故选B.
点评 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.碳、氮及其化合物在工农业生产生活中有着重要作用.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前使用最广泛的人工固氮的方法.请回答下列问题:
450℃时,往一个2L的密闭容器中充入2.6molH2和1molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示
(1)5min内,消耗N2的平均反应速率为0.008mol.L-1.min-1
此条件下该反应的化学平衡常数值为0.1
(2)若改变某一条件,达新平衡时n(H2)=1.6mol,下列说法正确的是BD
A.平衡一定正向移动
B.可能是降低了容器的温度
C.可能是向容器中加入了一定量的H2气体
D.可能是缩小了容器的体积
(3)另一种人工固氮的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和O2. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-489kJ/mol
请根据以上信息,写出人工固氮新方法的热化学方程式2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol
工业上也可在碱性溶液中通过电解的方法实现上述反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O
(4)如图1表示500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:14.5%.
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2: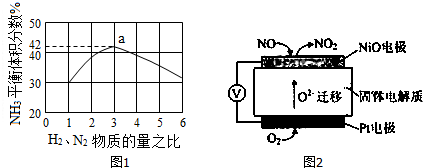
写出NiO电极的电极反应式:NO+O2--2e-=NO2
(6)①2NH3(g)+CO2(g)?NH2COONH4(s),此反应温度越低越容易自发进行,则该反应正向为放热反应(填“吸”或“放”).若将一定量NH2COONH4(s)置于恒温密闭容器中,其分解达到平衡状态,此时容器内压强为P1,混合气体的密度为ρ1.缩小容器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2.则P1<P2(填“>”“=”或“<”),ρ1<ρ2(填“>”“=”或“<”).
②在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按如表数据投料,反应达到平衡状态,测得体系压强升高.简述该反应的平衡常数与温度的变化关系:升高温度平衡常数减小
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前使用最广泛的人工固氮的方法.请回答下列问题:
450℃时,往一个2L的密闭容器中充入2.6molH2和1molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
此条件下该反应的化学平衡常数值为0.1
(2)若改变某一条件,达新平衡时n(H2)=1.6mol,下列说法正确的是BD
A.平衡一定正向移动
B.可能是降低了容器的温度
C.可能是向容器中加入了一定量的H2气体
D.可能是缩小了容器的体积
(3)另一种人工固氮的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和O2. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-489kJ/mol
请根据以上信息,写出人工固氮新方法的热化学方程式2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol
工业上也可在碱性溶液中通过电解的方法实现上述反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O
(4)如图1表示500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:14.5%.
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:

写出NiO电极的电极反应式:NO+O2--2e-=NO2
(6)①2NH3(g)+CO2(g)?NH2COONH4(s),此反应温度越低越容易自发进行,则该反应正向为放热反应(填“吸”或“放”).若将一定量NH2COONH4(s)置于恒温密闭容器中,其分解达到平衡状态,此时容器内压强为P1,混合气体的密度为ρ1.缩小容器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2.则P1<P2(填“>”“=”或“<”),ρ1<ρ2(填“>”“=”或“<”).
②在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按如表数据投料,反应达到平衡状态,测得体系压强升高.简述该反应的平衡常数与温度的变化关系:升高温度平衡常数减小
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
20.相同温度下用惰性电极电解下列物质的水溶液,一段时间后溶液酸碱性不变的是( )
| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | CuSO4 |
10.下列分子只表示一种物质的是( )
| A. | C3H7Cl | B. | C3H8 | C. | C4H10 | D. | C2H6O |
17.下列实验误差分析正确的是( )
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大 |
14.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |  | 烧杯中有白色胶状沉淀生成 | 非金属性:N>C>Si |
| A. | A | B. | B | C. | C | D. | D |
15.具有手性碳原子的物质具有旋光性,存在对映异构体,下列化合物中存在对映异构体的是( )
| A. | CH3CHClCH2CH3 | B. | CH3CH3 | C. | 甲烷 | D. | CH3COOH |
 O3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)
O3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)