题目内容
20.相同温度下用惰性电极电解下列物质的水溶液,一段时间后溶液酸碱性不变的是( )| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | CuSO4 |
分析 A.电解HCl溶液,本质是电解HCl,电解后HCl的浓度减小;
B.电解NaOH溶液,本质是电解水,NaOH的浓度可能增大;
C.电解Na2SO4溶液,本质是电解水,但硫酸钠溶液为中性;
D.电解CuSO4溶液,铜离子、水均放电,有硫酸生成.
解答 解:A.电解HCl溶液,本质是电解HCl,电解后HCl的浓度减小,溶液酸性减弱,故A错误;
B.电解NaOH溶液,本质是电解水,若原溶液为饱和溶液,NaOH浓度不变,溶液pH不变,若不是饱和溶液,NaOH的物质的量不变,但溶液体积减小,溶液碱性增强,故B错误;
C.电解Na2SO4溶液,本质是电解水,Na2SO4的物质的量不变,溶液浓度增大,但硫酸钠溶液为中性,溶液酸碱性不变,故C正确;
D.电解CuSO4溶液时,电池总反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,有H2SO4生成,溶液酸性增强,故D错误,
故选:C.
点评 本题考查电解原理,关键是理解掌握电极反应与离子放电顺序,电解本质是氧化还原反应,根据氧化性、还原性强弱理解离子放电顺序.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
8.下列说法正确的是( )
| A. | 二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减小 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以增大生成氢气的速率 | |
| C. | N2(g)+3H2(g)=2NH3(g)达到平衡后,增大c(N2)平衡向右移动,N2的转化率增大 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以增大反应速率 |
15.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,使压强刚好与外界相等.在相同温度下,发生2SO2+O2?2SO3并达到平衡.在这个过程中,甲容器保持体积不变,乙容器保持压强不变.若甲容器中SO2 的转化率为α,则乙容器中SO2 的转化率为( )
| A. | 等于α | B. | 大于α | C. | 小于α | D. | 无法确定 |
5.下列事实能用勒夏特列原理解释的是( )
| A. | 由H2、I2、HI组成的平衡体系加压后颜色变深 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 使用催化剂可加快SO2转化为SO3的速率 | |
| D. | 将木炭粉碎后与O2反应,速率更快 |
9.下列图示与对应的叙述相符的是( )
| A. |  所示的总反应为吸热反应 | |
| B. |  可表示3A(g)?2B(g)+C(s)受不同压强的影响,且乙的压强比甲的压强大 | |
| C. |  所示实验为用0.01mol•L-1的HCl溶液滴定20mL 0.01mol•L-1的NaOH溶液 | |
| D. |  依据,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH约为4.0 |
10.下列图示实验正确的是( )
| A. |  除去粗盐溶液中的不溶物 | B. | 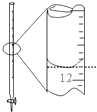 记录滴定终点读数为12.20ml | ||
| C. | 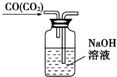 除去CO气体中的CO2气体 | D. | 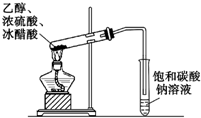 乙酸乙酯制备演示实验 |