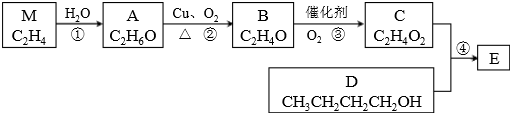
题目内容
20.下列说法正确的是( )| A. | 25℃时,将pH=a的一元强酸溶液与pH=14-a的一元碱溶液等体积混合后,所得溶液呈酸性或中性 | |
| B. | 相同温度的盐酸和醋酸两种溶液中,若c(Cl-)=c(CH3COO-),则两溶液pH相同 | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) | |
| D. | 对于沉淀溶解平衡AgX?Ag++X-,已知AgCl的平衡常数大于AgI.则含AgCl和AgI固体的悬浊液中存在:c(Ag+)>c(I-)>c(Cl-) |
分析 A、pH=a的一元强酸溶液中,c(H+)=10-amol/L,pH=14-a的一元碱溶液中,c(H+)=10a-14mol/L,则c(OH-)=10-amol/L;
B、根据电荷守恒来分析;
C、0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合所得溶液中,Na2CO3溶液与 NaHCO3的浓度均为0.05mol/L,根据电荷守恒和物料守恒来分析;
D、由于AgCl的平衡常数大于AgI,根据Ksp来分析.
解答 解:A、pH=a的一元强酸溶液中,c(H+)=10-amol/L,pH=14-a的一元碱溶液中,c(H+)=10a-14mol/L,则c(OH-)=10-amol/L,故将两溶液等体积混合后,;两者恰好完全反应,则所得溶液显中性,故A错误;
B、根据电荷守恒可知,在盐酸溶液中有:c(H+)=c(Cl-)+c(OH-),而在醋酸溶液中有:c(H+)=c(CH3COO-)+c(OH-),两溶液中若c(Cl-)=c(CH3COO-),则两溶液中c(H+)和c(OH-)均相等,即pH相同,故B正确;
C、0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合所得溶液中,Na2CO3溶液与 NaHCO3的浓度均为0.05mol/L,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),根据物料守恒可知:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+),两式联立可知:c(CO32-)+2c(OH-)═c(HCO3-)+3c(H2CO3)+2c(H+),故C错误;
D、由于是含AgCl和AgI固体的悬浊液,且AgCl的平衡常数大于AgI,则有:$\frac{c(A{g}^{+})•c(C{l}^{-})}{c(A{g}^{+})•c({I}^{-})}$=$\frac{{K}_{sp(AgCl)}}{{K}_{sp(AgI)}}$>1,故c(Cl-)>c(I-),故D错误.
故选B.
点评 本题考查了酸碱混合后溶液酸碱性的判断、盐溶液中的电荷守恒、物料守恒的运用和溶解平衡中的Ksp的有关计算,难度中等,综合性较强.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 2SO2(g)+O2(g)═2SO3(l)+Q,Q>196.64kJ | |
| B. | 2mol SO2气体和过量的O2充分反应放出196.64kJ热量 | |
| C. | 1 L SO2(g)完全反应生成1L SO3(g),放出98.32 kJ热量 | |
| D. | 使用催化剂,可以减少反应放出的热量 |
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-=CaSO3↓ | |
| B. | 通入HCl至溶液pH=7:c(Na+)=2c(SO32-)+c(HSO3-)+c(Cl-) | |
| C. | 加入NaOH固体可使溶液中水的电离程度增大 | |
| D. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| A. | CH3COONa溶液中加入少量KCl固体后的碱性溶液一定有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+) | |
| B. | 同浓度的CH3COONa和NaClO混合液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL(忽略溶液体积变化) | |
| D. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05 mol•L-1(忽略溶液体积变化) |
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 双酚A属于酚类 | B. | 双酚A属于芳香族化合物 | ||
| C. | 双酚A与苯酚互为同系物 | D. | 双酚A不属于醇类 |
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-但无法确定有无Cl- |
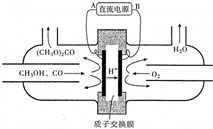 (1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).