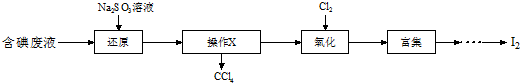
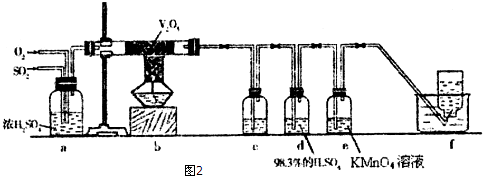
题目内容
8.下列不正确的是( )| A. | CH3COONa溶液中加入少量KCl固体后的碱性溶液一定有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+) | |
| B. | 同浓度的CH3COONa和NaClO混合液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL(忽略溶液体积变化) | |
| D. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05 mol•L-1(忽略溶液体积变化) |
分析 A.CH3COONa溶液中加入少量KCl固体后的碱性溶液中c(K)=c(Cl),溶液中存在电荷守恒分析;
B.同浓度的CH3COONa和NaClO混合液中次氯酸根离子水解程度大于醋酸根离子浓度;
C.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL;
D.依据酸碱反应量计算,结合氮元素守恒分析;
解答 解:A.CH3COONa溶液中加入少量KCl固体后的碱性溶液中c(K)=c(Cl),溶液中存在电荷守恒,c(Na+)+c(H+)+c(K+)=c(OH-)+c(CH3COO-)+c(Cl-),得到
c(Na+)-c(CH3COO-)=c(OH-)-c(H+),故A正确;
B.同浓度的CH3COONa和NaClO混合液中次氯酸根离子水解程度大于醋酸根离子浓度,溶液显碱性,c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故B错误;
C.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL,所以所得溶液的总体积V≤20ml,故C正确;
D.某温度下,pH=11的NH3•H2O氢氧根离子浓度为10-3mol/L,和pH=1的盐酸溶液中氢离子浓度为0.1mol/L;等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应生成氯化铵浓度为0.05mol/L;依据氮元素守恒,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05mol•Lˉ1,故D正确;
故选B.
点评 本题考查了酸碱反应后溶液中酸碱性的分析判断,主要是电解质溶液中电荷守恒、弱电解质电离平衡的应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
18.下列有关叙述中正碗的是( )
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
13.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
实验流程如下:

已知K2MnO4溶液显绿色,KMnO4溶液紫红色.请回答下列问题:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.醋酸 C.盐酸 D.硫酸
(3)下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(5)烘干时,温度控制在80℃为宜,温度不宜过高的理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(6)通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①滴定过程溶液中发生的离子反应为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶、胶头滴管.
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将偏小.
④滴定终点溶液的颜色变化是溶液由红色变无色.
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为$\frac{CVM}{250W}$×100%(高锰酸钾摩尔质量用M表示).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

已知K2MnO4溶液显绿色,KMnO4溶液紫红色.请回答下列问题:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.醋酸 C.盐酸 D.硫酸
(3)下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(5)烘干时,温度控制在80℃为宜,温度不宜过高的理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(6)通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①滴定过程溶液中发生的离子反应为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶、胶头滴管.
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将偏小.
④滴定终点溶液的颜色变化是溶液由红色变无色.
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为$\frac{CVM}{250W}$×100%(高锰酸钾摩尔质量用M表示).
20.下列说法正确的是( )
| A. | 25℃时,将pH=a的一元强酸溶液与pH=14-a的一元碱溶液等体积混合后,所得溶液呈酸性或中性 | |
| B. | 相同温度的盐酸和醋酸两种溶液中,若c(Cl-)=c(CH3COO-),则两溶液pH相同 | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) | |
| D. | 对于沉淀溶解平衡AgX?Ag++X-,已知AgCl的平衡常数大于AgI.则含AgCl和AgI固体的悬浊液中存在:c(Ag+)>c(I-)>c(Cl-) |

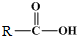 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$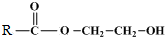
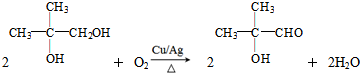 .
. .
.