题目内容
16.下列各组物质全部是弱电解质的是( )| A. | H2SiO3 H2S CO2 | B. | H2O NH3•H2O H3PO4 | ||
| C. | H2SO3 BaSO4 CH4 | D. | MgSO4 CH3COOH CH3CH2OH |
分析 只有部分电离的电解质是弱电解质,弱酸、弱碱和水都属于弱电解质.
解答 解:A.H2SiO3 和 H2S属于弱酸是弱电解质,CO2本身不能电离出离子属于非电解质,故A错误;
B.H2O、NH3•H2O、H3PO4 水溶液中部分电离属于弱电解质,故B正确;
C.H2SO3 水溶液中部分电离属于弱电解质,BaSO4 熔融状态全部电离属于强电解质,CH4 不能电离属于非电解质,故C错误;
D.MgSO4 属于盐是强电解质,CH3COOH 水溶液中部分电离属于弱电解质,CH3CH2OH不能电离属于非电解质,故D错误;
故选B.
点评 本题考查了强弱电解质的划分,明确其划分标准是电解质的电离程度,掌握概念的实质是解题关键,题目难度不大.

练习册系列答案
相关题目
18.依反应①2W-+X2═2X-+W2;②2Y-+W2═2W-+Y;③2X-+Z2=2Z-+X2不下列结论正确的是( )
| A. | X-、Y-、Z-、W-中Z-还原性最强 | B. | X2、Y2、Z2、W2中Z2的氧化性最强 | ||
| C. | 2Z-+Y2═-+Z2不能向右进行 | D. | 还原性X->Y- |
5.下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②SrSO4是难溶于水的白色固体
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤因为常温下白磷可自然,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑥Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱.
①热稳定性:H2O>HF>H2S
②SrSO4是难溶于水的白色固体
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤因为常温下白磷可自然,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑥Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱.
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
6.下列气体中能形成酸雨的是( )
| A. | N2 | B. | CO | C. | SO2 | D. | O3 |
 ;
;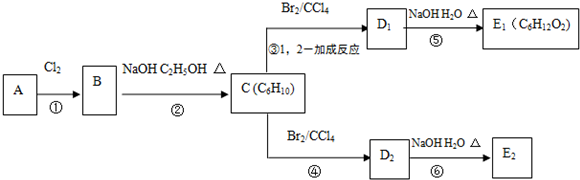

 .
.
 的化学方程式:
的化学方程式: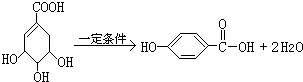 .
.