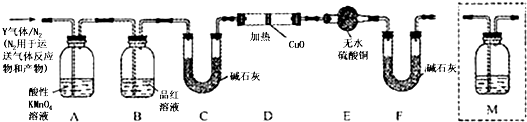
题目内容
5.下列叙述正确的是( )①热稳定性:H2O>HF>H2S
②SrSO4是难溶于水的白色固体
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤因为常温下白磷可自然,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑥Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱.
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②同主族元素化合物的性质具有相似性;
③ⅠA、ⅡA族元素的原子失掉最外层电子形成阳离子;
④过渡元素都是金属元素;
⑤由同主族元素的性质可知,从上到下非金属减弱;
⑥Li燃烧生成Li2O,从上到下,金属性增强.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故错误;
②第ⅡA元素硫酸盐性质的递变规律,硫酸钡(BaSO4)是难溶于水的白色固体,则硫酸锶(SrSO4)是难溶于水的白色固体,故正确;
③H+最外层没有电子,其它ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素的原子的核外电子排布少一个电子层,所以ⅠA、ⅡA族元素的阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布(氢元素除外),故错误;
④从ⅢB族到ⅡB族10个纵行的元素属于过渡元素,过渡元素都是金属元素,故正确;
⑤不能利用反应条件比较非金属性,由同主族元素的性质可知,从上到下非金属减弱,则非金属性为N>P,故错误;
⑥Li燃烧生成Li2O,从上到下,金属性增强,则LiOH为弱碱,故错误;
故选A.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及氢化物越稳定、金属性和非金属性比较等,把握元素的位置、元素周期律即可解答,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
6.如图是氯化钠晶体和二氧化碳晶体的结构示意图,关于两种晶体说法正确的是( )
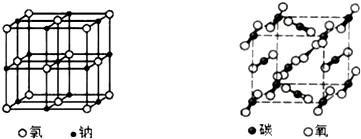

| A. | 两种晶体内均含有共价键 | B. | 构成两种晶体的微粒均是原子 | ||
| C. | 两者的硬度、熔沸点差别较大 | D. | 两种晶体均属于离子晶体 |
16.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3 H2S CO2 | B. | H2O NH3•H2O H3PO4 | ||
| C. | H2SO3 BaSO4 CH4 | D. | MgSO4 CH3COOH CH3CH2OH |
20.下列一定是放热反应的是( )
| A. | 氧化还原反应 | B. | 离子反应 | C. | 复分解反应 | D. | 缓慢氧化 |
10.根据下列事实:
①在溶液中,A+N2+═A2++N;
②D+2H2O═D(OH)2+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+.
下列各项比较关系正确的是( )
①在溶液中,A+N2+═A2++N;
②D+2H2O═D(OH)2+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+.
下列各项比较关系正确的是( )
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |
17.下列反应属于取代反应的是( )
| A. | 乙烯水化法制乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 乙醛与新制氢氧化铜反应 |
14.下列分子中,只有σ键而没有π键的是( )
| A. | N2 | B. | H2 | C. | CH2═CH2 | D. | CH≡CH |
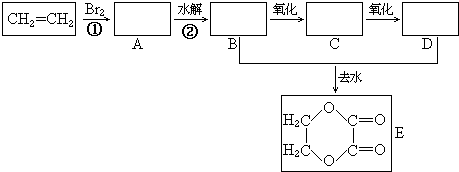
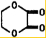 +2H2O.
+2H2O.