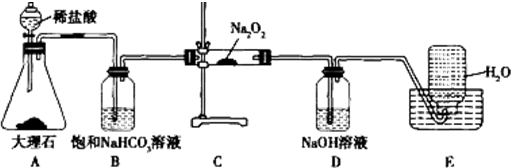
题目内容
9.中国是世界炼锌的发源地,宋应星著于明崇祯十年(1637年)的《天工开物》一书则是最早记述炼锌技术的典籍.回答下列问题:Ⅰ.《天工开物》中有关于“升炼倭铅”的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅(金属锌)也.”
(1)该炼锌工艺过程主要反应的化学方程式为ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
Ⅱ.目前,工业上主要采用“湿法炼锌”.以闪锌矿(主要成分为 ZnS,含有FeS等杂质)为原料冶炼锌的工艺流程如图所示.
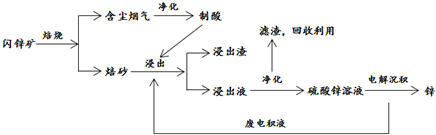
(2)闪锌矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的成分的化学式为ZnO、Fe2O3.
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸的名称是硫酸.工业上常采用“针铁矿法”净化浸出液,在80~100℃,Fe3+浓度低于1g/L,调节浸出液的pH在3~5之间,溶液中的铁可以呈针铁矿(FeOOH)的形式析出.
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将其中的Fe3+还原为Fe2+,再以ZnO调节酸度,在空气缓慢氧化得
Fe3+,最后Fe3+ 转化成针铁矿沉淀.Fe2+沉淀过程的总离子方程式为4Fe2++O2+4ZnO+2H2O=4FeOOH+4Zn2+.
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在阴极上析出金属锌,电解过程的化学反应方程式为2ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Zn+2H2SO4+O2↑.
分析 Ⅰ.(1)碳酸锌与碳在高温下反应生成锌和一氧化碳,结合氧化还原反应得失电子守恒配平方程式;
Ⅱ.闪锌矿(主要成分为 ZnS,含有FeS等杂质焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,净化除去铁元素,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(2)含锌矿的主要成分是ZnS、FeS,与空气中氧气发生氧化还原反应,判断焙砂的主要成分;
(3)含尘烟气含有含硫氧化物,根据元素守恒判断酸的名称;
(4)除去浸出液的Fe3+,可以用SO2或ZnS将铁离子还原,再以ZnO调节酸度,同时亚铁离子被空气氧化得FeOOH而除去铁元素,根据电荷守恒书写离子方程式;
(5)电解硫酸锌溶液,锌离子在阴极被还原成锌单质,阳极上氢氧根放电生成氧气,据此书写电解方程式.
解答 解:Ⅰ.(1)碳酸锌与碳在高温下反应生成锌和一氧化碳,化学方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,
故答案为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑;
Ⅱ.闪锌矿(主要成分为 ZnS,含有FeS等杂质焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,净化除去铁元素,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(2)含锌矿的主要成分是ZnS、FeS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO、Fe2O3,
故答案为:ZnO、Fe2O3;
(3)含尘烟气含有含硫氧化物,根据元素守恒可知,制得的酸为硫酸,
故答案为:硫酸;
(4)除去浸出液的Fe3+,可以用SO2或ZnS将其中的 Fe3+还原为Fe2+,再以ZnO调节酸度,同时亚铁离子被空气氧化得FeOOH而除去铁元素,反应的离子方程式为4Fe2++O2+4ZnO+2H2O=4FeOOH+4Zn2+,
故答案为:其中的 Fe3+还原为Fe2+;4Fe2++O2+4ZnO+2H2O=4FeOOH+4Zn2+;
(5)电解硫酸锌溶液,锌离子在阴极被还原成锌单质,阳极上氢氧根放电生成氧气,电解的化学方程式为2ZnSO4+2H2O $\frac{\underline{\;电解\;}}{\;}$2Zn+2H2SO4+O2↑,
故答案为:阴极;2ZnSO4+2H2O $\frac{\underline{\;电解\;}}{\;}$2Zn+2H2SO4+O2↑.
点评 本题以流程题的形成考查物质的分离、提纯,为高考成常见题型,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质以及实验的原理,难度不大.

| A. | Ca(OH)2 | B. | Mg(OH)2 | C. | KOH | D. | NaOH |
| A. | 分子式相同,各元素的质量分数也相同的物质是同种物质 | |
| B. | 通式相同的不同物质一定是同分异构体 | |
| C. | 分子式相同的不同物质一定是同分异构体 | |
| D. | 相对分子质量相同的不同物质一定是同分异构体 |
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 标准状况下,1 molCH2Cl2所占有的体积约为22.4L | |
| C. | 常温常压下,38g 18OH-中含质子数20NA | |
| D. | 14g C2H4和C3H6的混合气体含有的原子总数为3NA |
| A. | XO${\;}_{3}^{-}$中X为+5价,故X元素位于第ⅤA族 | |
| B. | X位于第二周期第ⅦA族 | |
| C. | X一定是氯元素 | |
| D. | X可能是氮元素 |
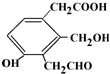 ,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1;消耗H2、Br2(水)的物质的量之比为2:1.
,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1;消耗H2、Br2(水)的物质的量之比为2:1.