题目内容
14.某强氧化剂XO(OH)2+能被Na2SO3还原到较低价态.如果还原含2.4×10-3mol XO(OH)2+的溶液至较低价态,需要30mL 0.2mol/L 的Na2SO3溶液,那么X元素的最终价态是( )| A. | +2 | B. | +1 | C. | 0 | D. | -1 |
分析 Na2SO3还原2.4×10-3molXO(OH)2+到X元素的最终价态,则Na2SO3被氧化为Na2SO4,反应中S元素的化合价由+4价升高为+6价,令X元素在还原产物中的化合价为a,根据电子转移守恒计算a的值.
解答 解:Na2SO3还原2.4×10-3molXO(OH)2+到X元素的低价态,则Na2SO3被氧化为Na2SO4,反应中S元素的化合价由+4价升高为+6价,
令X元素在还原产物中的化合价为a,
由电子守恒可知,2.4×10-3mol×(5-a)=0.03L×0.2mol•L-1×(6-4),
解得a=0,
故选C.
点评 本题考查氧化还原反应的有关计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,题目难度不大,注意计算中守恒思想的运用.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
4.下列说法正确的是( )
| A. | 反应CaCO3(s)═CaO(s)+CO2(g)在常温下不能自发进行,则该反应的△H<0 | |
| B. | 0.lmol•L一1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值减小 | |
| C. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| D. | 锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
5.如图所示,在小烧杯中加入水和煤油各20mL,然后将一小粒金属钠放入烧杯中,观察到的现象可能为( )
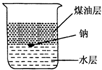

| A. | 钠在水层中反应并四处游动 | |
| B. | 钠停留在煤油层中不发生反应 | |
| C. | 钠在煤油的液面上反应并四处游动 | |
| D. | 钠在水与煤油的界面处反应并上下跳动 |
2.在标准状况下,与12g H2的体积相等的N2( )
| A. | 质量为12g | B. | 物质的量为6mol | ||
| C. | 体积约为22.4L | D. | 分子数约为6.02×1023 |
9.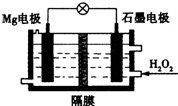 Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )
Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )
Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )| A. | Mg电极是该电池的负极 | B. | H2O2在石墨电极上发生还原反应 | ||
| C. | 石墨电极附近溶液的pH减小 | D. | 溶液中Cl-向负极移动 |
19.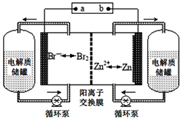 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| B. | 放电时正极的电极反应式为Br2+2e-═2Br- | |
| C. | 充电时电极b连接电源的正极 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
