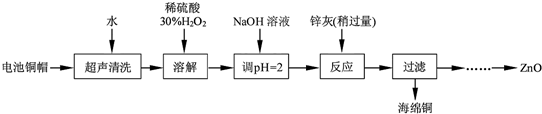
题目内容
9.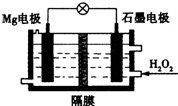 Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )
Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )| A. | Mg电极是该电池的负极 | B. | H2O2在石墨电极上发生还原反应 | ||
| C. | 石墨电极附近溶液的pH减小 | D. | 溶液中Cl-向负极移动 |
分析 镁、过氧化氢和海水形成原电池,镁做负极发生氧化反应,过氧化氢在正极上发生还原反应,过氧化氢做氧化剂被还原为氢氧根,溶液pH增大,原电池中阴离子移向负极.
解答 解:A、组成的原电池的负极被氧化,镁为负极,而非正极,故A错误;
B、双氧水作为氧化剂,在石墨上被还原变为水和氢氧根离子,发生还原反应,故B错误;
C、双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,电极反应为,H2O2+2e-=2OH-,故溶液pH值增大,故C正确;
D.溶液中Cl-移动方向同外电路电子移动方向一致,应向负极方向移动,故D错误;
故选C.
点评 本题考查了原电池原理,由Mg、双氧水的性质确定正负极,会正确书写电极反应式,知道离子移动方向,题目难度不大.

练习册系列答案
相关题目
20.配合物[Ag(NH3)2]OH中,不存在的化学键是( )
| A. | 离子键 | B. | 金属键 | C. | 氢键 | D. | 配位键 |
4.下列与实验相关的叙述正确的是( )
| A. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| B. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| C. | 用激光笔验证淀粉溶液的丁达尔现象 | |
| D. | 用洁净的玻璃棒蘸取碳酸钾溶液在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
14.某强氧化剂XO(OH)2+能被Na2SO3还原到较低价态.如果还原含2.4×10-3mol XO(OH)2+的溶液至较低价态,需要30mL 0.2mol/L 的Na2SO3溶液,那么X元素的最终价态是( )
| A. | +2 | B. | +1 | C. | 0 | D. | -1 |
18.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3+3H+ | |
| C. | 90℃时,测得纯水中Kw=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| D. | 用热的纯碱溶液可以清洗油污:CO32-+H2O?HCO3-+OH- |
19.常温下,取0.1mol•L-1 H2X溶液与0.2mol•L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法正确的是( )
| A. | c(Na+)=2c(X2-) | B. | c(OH-)=c(H+)+2c(H2X)+c(HX-) | ||
| C. | c(X-)>c(Na+)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(X2-)+c(HX-) |