题目内容
14.下列操作的原理或对应的离子方程式不正确的是( )| A. | Mg (HCO3)2溶液中加入足量的Ba(OH)2:Mg2++2HCO3-+2Ba2++4OH-═Mg(OH)2↓+2BaCO3↓+2H2O | |
| B. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | K2Cr2O7溶液中加入氢氧化钠溶液,溶液颜色由橙色变成黄色,证明溶液中存在平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2混合来证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.Mg (HCO3)2完全反应,生成氢氧化镁、碳酸钡、水;
B.发生氧化还原反应生成S、二氧化硫;
C.加入氢氧化钠溶液,平衡Cr2O72-+H2O?2CrO42-+2H+正向移动;
D.盐酸、H2O2均能被高锰酸钾氧化.
解答 解:A.Mg (HCO3)2完全反应,生成氢氧化镁、碳酸钡、水,离子反应为Mg2++2HCO3-+2Ba2++4OH-═Mg(OH)2↓+2BaCO3↓+2H2O,故A正确;
B.发生氧化还原反应生成S、二氧化硫,离子反应为S2O32-+2H+═SO2↑+S↓+H2O,遵循电子、电荷守恒,故B正确;
C.加入氢氧化钠溶液,平衡Cr2O72-+H2O?2CrO42-+2H+正向移动,则溶液颜色由橙色变为黄色,故C正确;
D.盐酸、H2O2均能被高锰酸钾氧化,则不能证明H2O2具有还原性,可利用硫酸酸化高锰酸钾,故D错误;
故选D.
点评 本题考查离子方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.在恒温容积为2L的密闭容器中进行反应N2(g)+3H2(g)?2NH3(g),若氨气的物质的量由0.4mol降到0.24mol需2s,那么由0.24mol降到0.04mol,需要的反应时间为( )
| A. | 等于2.5s | B. | 等于2.0s | C. | 大于2.5s | D. | 小于2.0s |
2.现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依此是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、分液、蒸馏 | C. | 萃取、蒸馏、分液 | D. | 分液、蒸馏、萃取 |
9.下列物质中,属于电解质的是( )
| A. | CH4 | B. | Al | C. | HCl | D. | 稀H2SO4 |
19.常温常压下,下列化合物以液态形式存在的是( )
| A. | 乙烷 | B. | 丙烯 | C. | 乙醇 | D. | 丙炔 |
6.除去下列物质中含有的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
| B | 乙炔(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 苯(甲苯) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
4.已知有如下反应:①KClO3+6HCl═3Cl2↑+3H2O+KCl,②2FeCl3+2KI═2FeCl2+2KCl+I2,
③2FeCl2+Cl2═2FeCl3,下列说法正确的是( )
③2FeCl2+Cl2═2FeCl3,下列说法正确的是( )
| A. | 反应①中氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 反应②中FeCl3只作氧化剂,反应③中FeCl3只是氧化产物 | |
| C. | 反应②中每生成127g I2,转移的电子数为2NA | |
| D. | 根据上述三个反应可知氧化性:ClO3->Cl2>Fe3+>I2 |

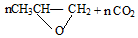 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$

