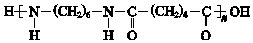题目内容
4.已知有如下反应:①KClO3+6HCl═3Cl2↑+3H2O+KCl,②2FeCl3+2KI═2FeCl2+2KCl+I2,③2FeCl2+Cl2═2FeCl3,下列说法正确的是( )
| A. | 反应①中氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 反应②中FeCl3只作氧化剂,反应③中FeCl3只是氧化产物 | |
| C. | 反应②中每生成127g I2,转移的电子数为2NA | |
| D. | 根据上述三个反应可知氧化性:ClO3->Cl2>Fe3+>I2 |
分析 A、根据①KClO3+6HCl═3Cl2↑+3H2O+KCl反应中KClO3中Cl元素化合价由+5降低到0价的Cl2,HCl中Cl元素化合价由-1价升高到0价的Cl2判断;
B、根据化合价降低为氧化剂,还原剂生成氧化产物判断;
C、根据反应②2FeCl3+2KI═2FeCl2+2KCl+I2,生成1mol I2转移2mol电子计算;
D、根据氧化剂的氧化性大于氧化产物的氧化性判断.
解答 解:A、①KClO3+6HCl═3Cl2↑+3H2O+KCl反应中KClO3中Cl元素化合价由+5降低到0价为氧化剂,HCl中Cl元素化合价由-1价升高到0价为还原剂,所以氧化剂与还原剂的物质的量之比为1:5,故A错误;
B、②2FeCl3+2KI═2FeCl2+2KCl+I2反应中FeCl3中Fe元素化合价由+3降低到+2价为氧化剂,③2FeCl2+Cl2═2FeCl3,FeCl3既是氧化产物又是还原产物,故B错误;
C、反应②2FeCl3+2KI═2FeCl2+2KCl+I2,生成1mol I2转移2mol电子,所以每生成127g I2,转移的电子数为$\frac{127}{254}$×2=1NA,故C错误;
D、①KClO3+6HCl═3Cl2↑+3H2O+KCl中,氧化性:ClO3->Cl2;
②2FeCl3+2KI═2FeCl2+2KCl+I2,氧化性:Fe3+>I2;
③2FeCl2+Cl2═2FeCl3中,氧化性:Cl2>Fe3+,所以氧化性强弱的顺序为:ClO3->Cl2>Fe3+>I2,故D正确.
故选D.
点评 本题考查学生氧化还原反应中氧化剂和还原剂强弱的判断知识,属于综合知识的考查,难度中等,抓住化合价变化即可解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列属于电解质的是( )
| A. | 铜 | B. | 氨水 | C. | 氧化钠 | D. | 蔗糖 |
14.下列操作的原理或对应的离子方程式不正确的是( )
| A. | Mg (HCO3)2溶液中加入足量的Ba(OH)2:Mg2++2HCO3-+2Ba2++4OH-═Mg(OH)2↓+2BaCO3↓+2H2O | |
| B. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | K2Cr2O7溶液中加入氢氧化钠溶液,溶液颜色由橙色变成黄色,证明溶液中存在平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2混合来证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
18.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O=2H++C1-+C1O- | |
| B. | 铝溶于过量的氨水:A1+2OH-+H2O=A1O2-+2H2↑ | |
| C. | 检验溶液中的 NH4+:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| D. | 用 H2S 处理含 Hg2+的废水:S2-+Hg2+=HgS↓ |
9.下列说法正确的是( )
| A. | 原电池是把电能转化成化学能的装置 | |
| B. | 原电池内部的阴离子向正极移动 | |
| C. | 原电池的两极分别发生氧化反应和还原反应 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
16.将0.4molSO2和0.2molO2置于密闭容器中发生反应:2SO2+O2$?_{催化剂}^{高温}$2SO3.下列关于该反应的说法正确的是( )
| A. | 最终可生成0.4molSO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
13. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 有1mol电子转移时,反应的氧气为5.6L | |
| C. | 外电路中电流由电极b通过导线流向电极a | |
| D. | 电极b的反应为:O2+4e-+H2O=4OH- |
8. 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 苛性钾溶液中KOH的质量是16.8 | |
| B. | 反应中转移电子0.21mol | |
| C. | 氯气被还原成0.06molClO-和0.03molClO3- | |
| D. | ClO3-的生成是由于温度升高引起的 |
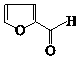 ).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(
).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(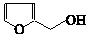 ),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.
),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.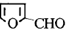 +H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$
+H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$