题目内容
12.下列说法错误的是( )| A. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原则 | |
| B. | 6C的电子排布式1s22s22p${\;}_{x}^{\;}$2违反了洪特规则 | |
| C. | ns电子的能量不一定高于(n-1)p电子的能量 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
分析 A.应先排能量低的4s轨道;
B.洪特规则:在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低.所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道;
C.电子能量与能层和能级都有关;
D.泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态 相反的电子.
解答 解:A.应先排能量低的4s轨道,而不是排能量高的3d,违反了能量最低原理,故A正确;
B.根据洪特规则知,2p轨道上的两个电子应排在不同轨道上,故B正确;
C.电子能量与能层和能级都有关,ns电子的能量一定高于(n-1)p电子的能量,故C错误;
D.根据泡利不相容原理知,3p轨道最多排6个电子,故D正确;
故选C.
点评 本题考查了基本概念,明确洪特规则、泡利不相容原理、能量最低原理即可解答,难度不大.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 16g18O2含有的中子数为10NA | B. | 1.9g1H37Cl含有的电子数为0.9NA | ||
| C. | lmolN2中共用电子对数为3NA | D. | 0.5molNH4+含有的质子数为5.5NA |
20.下列有关化学用语表示正确的是( )
| A. | N2的电子式: | B. | 氯原子的结构示意图为: | ||
| C. | MgCl2的形成过程: | D. | NH3的电子式: |
4.“摇摇冰”是一种即用即冷的饮料.吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷.该化学物质可能是( )
| A. | 硝酸铵 | B. | 氯化钠 | C. | 生石灰 | D. | 蔗糖 |
1.下列说法正确的是( )
| A. | 若把H2S分子写成H3S分子,违背了共价键的饱和性 | |
| B. | H3O+的存在,说明共价键没有饱和性 | |
| C. | 所有的共价键都有方向性 | |
| D. | 凡是有空轨道的微粒,都能接受孤电子对形成牢固的配位键 |
2.X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:
回答下列问题:
(1)W在周期表的位置为第四周期第Ⅷ族,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(2)X的简单阴离子的结构示意图为 ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
(3)Z的氧化物在通讯领域的用途是光导纤维,工业上制备Z的单质的化学反应方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)YX3固体在熔融状态下不导电,则YX3固体中存在共价键;在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能有二种情况.
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为第四周期第Ⅷ族,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(2)X的简单阴离子的结构示意图为
 ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.(3)Z的氧化物在通讯领域的用途是光导纤维,工业上制备Z的单质的化学反应方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O.
(4)YX3固体在熔融状态下不导电,则YX3固体中存在共价键;在50mL l mol•L-1的YX3溶液中逐滴加入0.5mol•L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能有二种情况.
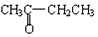
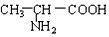 与
与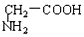
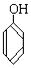 和
和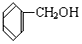
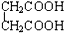 和
和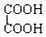
 .
.