题目内容
1.下列说法正确的是( )| A. | 若把H2S分子写成H3S分子,违背了共价键的饱和性 | |
| B. | H3O+的存在,说明共价键没有饱和性 | |
| C. | 所有的共价键都有方向性 | |
| D. | 凡是有空轨道的微粒,都能接受孤电子对形成牢固的配位键 |
分析 A.S最外层有6个电子,只有与2个H结合;
B.H3O+的存在,O原子提供电子对,H+提供1个空轨道;
C.s轨道为球形结构,s-s共价键无方向性;
D.钠离子等含空轨道,难形成配位键.
解答 解:A.S最外层有6个电子,只有与2个H结合,则把H2S分子写成H3S分子,违背了共价键的饱和性,故A正确;
B.H3O+的存在,O原子提供电子对,H+提供1个空轨道,则共价键有饱和性,故B错误;
C.s轨道为球形结构,s-s共价键无方向性,p-p共价键有方向性,故C错误;
D.钠离子等含空轨道,难形成配位键,一般过渡金属元素的空轨道能接受孤电子对形成牢固的配位键,故D错误;
故选A.
点评 本题考查配位键、共价键,为高频考点,把握原子结构、共价键的形成及判断为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
12.下列说法错误的是( )
| A. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原则 | |
| B. | 6C的电子排布式1s22s22p${\;}_{x}^{\;}$2违反了洪特规则 | |
| C. | ns电子的能量不一定高于(n-1)p电子的能量 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
16.下列各组物质中,相互间一定互为同系物的是( )
| A. | 邻二甲苯和对二甲苯 | B. | C4H8O2和C3H6O2 | ||
| C. | C4H10和C20H42 | D. | C6H5-OH和C6H5-CH2-OH |
6.I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O?CO2(g)+H2(g)得到如下三组数据:
(1)下列情况表明反应达到平衡状态的是C (填序号)
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
13.化学与社会、生产、生活、环境等密切相关,下列说法不正确的是( )
| A. | 东晋葛洪《肘后备急方》中记载了“青蒿一握,以水二升渍,绞取汁,…”,此过程属于物理变化 | |
| B. | 日本福岛核电站事故中,核原料裂变产生的2种放射性同位素碘-131和铯-137的中子数不同 | |
| C. | 乙烯与氧气在银催化作用下生成环氧乙烷符合绿色化学的原子经济性要求 | |
| D. | PM2.5是指天气中直径接近2.5×10-6m的颗粒物,其分散在空气中形成胶体 |
10.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 钠与水的反应 | D. | 铝热反应 |
11.M是中药狼把草的成分之一,具有消炎杀菌作用,其结构如图所示.下列叙述正确的是( )

| A. | M的分子式为C9H10O4 | |
| B. | M与浓溴水既能发生取代反应,又能发生加成反应 | |
| C. | 一定条件下,1 mol M最多能与3molH2发生反应 | |
| D. | M能分别与Na、NaOH、NaHCO3发生反应 |
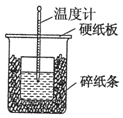 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: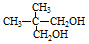 .
.