题目内容
2.下列有关物质的表达式不正确的是( )| A. | 1,3-丁二烯的分子式:C4H6 | B. | 溴乙烷的电子式: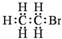 | ||
| C. | 甲醛的结构式: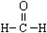 | D. | 葡萄糖的结构简式:CH2OH(CHOH)4CHO |
分析 A.1,3-丁二烯分子中含有2个碳碳双键,其分子中含有4个C、6个H;
B.溴乙烷为共价化合物,溴原子最外层达到8电子稳定结构;
C.甲醛分子中含有1个碳氧双键和1个碳氢键;
D.葡萄糖分子中含有5个羟基和1个醛基.
解答 解:A.1,3-丁二烯分子中含有2个碳碳双键,其分子式为:C4H6,故A正确;
B.溴乙烷为共价化合物,溴乙烷分子中存在5个碳氢共用电子对、一个碳溴共用电子对,溴乙烷的电子式为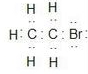 ,故B错误;
,故B错误;
C.甲醛为含有1个C的醛,其结构式为: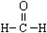 ,故C正确;
,故C正确;
D.葡萄糖分子中含有6个C原子,为多羟基醛,其结构简式为:CH2OH(CHOH)4CHO,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、分子式、结构式、结构简式等知识,明确常见化学用语的表示方法为解答关键,试题侧重考查学生的规范答题能力.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
13.下列7种有机物:①甲烷 ②苯 ③聚丙烯 ④2-丁炔 ⑤乙烯 ⑥邻二甲苯既能使酸性高锰酸钾褪色,又能与溴水反应褪色的是( )
| A. | ②③④⑤⑥ | B. | ③④⑤ | C. | ④⑤ | D. | ④⑤⑥ |
10.按C、N、O的顺序,下列递变规律不正确的是( )
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
(1)C的氢化物的结构式为H-S-H.
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物的化学式分别为SO2、SO3.
(5)A和D所形成化合物的晶体类型:离子晶体.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物的化学式分别为SO2、SO3.
(5)A和D所形成化合物的晶体类型:离子晶体.
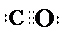 或
或 ,结构式为
,结构式为 .
.