题目内容
8.(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上没有(填“有”或“没有”)泡产生再用导线把锌片和铜片连接起来,组成一个原电池,正极的电极反应2H++2e-=H2↑.(2)有人以化学反应:2Zn+02+4H+=2Zn2++2H20为基础设计一种原电池,人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作.则原电池的负极材料是Zn或锌,正极发生的电极反应为O2+4H++4e-═2H2O.
分析 (1)稀硫酸和Zn发生置换反应生成氢气,和Cu不反应,用导线把锌片和铜片连接起来,组成一个原电池,锌易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应;
(2)由反应2Zn+O2+4H+═2Zn2++2H2O可知,Zn被氧化生成n2+,为负极反应,正极是氧气发生还原反应生成水,由此分析解答..
解答 解:(1)稀硫酸和Zn发生置换反应生成氢气,和Cu不反应,所以铜片上没有气泡,用导线把锌片和铜片连接起来,组成一个原电池,锌易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:没有;2H++2e-=H2↑;
(2)由反应2Zn+O2+4H+═2Zn2++2H2O可知,Zn被氧化生成n2+,为负极反应,正极是氧气发生还原反应生成水,电极反应式为:O2+4H++4e-═2H2O,故答案为:Zn或锌;O2+4H++4e-═2H2O.
点评 本题考查化学电源新型电池以及原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极反应,题目难度不大,本题注意基础知识的积累.

练习册系列答案
相关题目
18.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中,正确的是( )
| A. | 由2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO可推出同族的硫也有Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | 氯气能把碘离子氧化为单质碘,则氯气一定能把溴离子氧化为单质溴 | |
| D. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2一定只生成Na2SO3和O2 |
19.下列各原子序数的元素,能形成AB2型离子化合物的是( )
| A. | 1与8 | B. | 9与11 | C. | 6与16 | D. | 12与17 |
16.如图是以元素的原子序数为横坐标、原子的最外层电子数为纵坐标所绘出的四种元素的柱状图.

则下列关于四种元素的说法正确的是( )

则下列关于四种元素的说法正确的是( )
| A. | W和Z在同一周期 | |
| B. | 原子半径:W<X<Y<Z | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | W和X形成的简单化合物中只含有共价键 |
3.下列说法正确的是( )
| A. | 用核磁共振氢谱图可以鉴别乙醇和溴乙烷,该方法是物理方法 | |
| B. | 乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以转化成乙醛,乙醇和乙醛都能发生加成反应 | |
| D. | 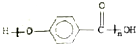 的结构中只含有羟基和羧基 的结构中只含有羟基和羧基 |
13.有机物 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )| A. | ②④⑥⑦ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①③④⑤⑦ |
20.下列实验操作中,正确的是( )
| A. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 在容量瓶中直接溶解氢氧化钠固体 |
1.下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制450mL溶液.
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制450mL溶液.
| A. | ①②③④ | B. | ①②④ | C. | ③⑤ | D. | ①②④⑤ |
2.下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4CBr4CsCl SiO2 |