题目内容
19.下列各原子序数的元素,能形成AB2型离子化合物的是( )| A. | 1与8 | B. | 9与11 | C. | 6与16 | D. | 12与17 |
分析 由原子序数判断元素,能形成AB2型离子化合物,则A为+2价金属,B为-1价非金属性,且A位于ⅡA族,B位于ⅤⅡA族,以此来解答.
解答 解:A.分别为H、O,只形成共价化合物,故A不选;
B.分别为F、Na,可形成离子化合物NaF,故B不选;
C.分别为C、S,只形成共价化合物,故C不选;
D.分别为Mg、Cl,能形成离子化合物MgCl2,故D选;
故选D.
点评 本题考查离子化合物,为高频考点,把握元素的原子序数、元素的化合价及元素的位置为解答的关键,侧重分析与应用能力的考查,注意活泼金属与非金属易形成离子键,题目难度不大.

练习册系列答案
相关题目
9.在标有“20℃25mL”的滴定管内装溶液至10.00mL时,管内液体的体积是( )
| A. | 15mL | B. | 小于15mL | C. | 大于15mL | D. | 无法判断 |
10.明矾[KAl(SO4)2•12H2O]在生产、生活中有广泛用途:饮用水的净化、食品工业的发酵剂等.利用炼铝厂的废料--铝灰(含Al、Al2O3及少量SiO2和FeO•xFe2O3)可制备明矾.工艺流程如下:

回答下列问题:
(1)明矾净水的原理是(用离子方程表示):Al3++3H2O?Al(OH)3+3H+;
(2)操作Ⅱ是:蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是②(只用一种试剂,填序号)
①KSCN溶液; ②KMnO4酸性溶液; ③KI淀粉溶液.
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
注:金属离子的起始浓度为0.1mol•L-1根据表中数据解释调pH=3.6的目的使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀.
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.
加入MnSO4发生反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+.滤渣2含有的物质是MnO2、Fe(OH)3.

回答下列问题:
(1)明矾净水的原理是(用离子方程表示):Al3++3H2O?Al(OH)3+3H+;
(2)操作Ⅱ是:蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是②(只用一种试剂,填序号)
①KSCN溶液; ②KMnO4酸性溶液; ③KI淀粉溶液.
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 7.5 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.
加入MnSO4发生反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+.滤渣2含有的物质是MnO2、Fe(OH)3.
7.能够说明硫的非金属性比氯弱的事实有( )
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态.
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态.
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①②③ |
14.下列说法正确的是( )
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
4.下列变化规律正确的是( )
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
11.混合物的分离是化学实验的一项基本内容,以下是中学化学实验中常用的几种分离操作示意图:
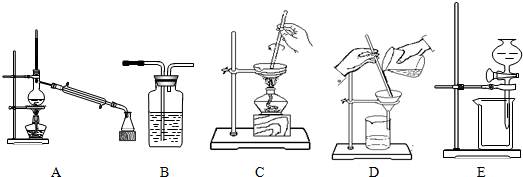
下表中的四项实验都需要进行分离操作,请从上述A~E中选择合适的分离操作,将序号填在表格中.

下表中的四项实验都需要进行分离操作,请从上述A~E中选择合适的分离操作,将序号填在表格中.
| 实验 | 所需分离操作 |
| 1.某活动小组用海水制取粗盐 | |
| 2.某活动小组从原油中分离出汽油、煤油等 | |
| 3.某活动小组将粗盐溶于水,除去其不溶的泥沙 | |
| 4.某活动小组用氢氧化钠溶液洗去CCl4中的I2 |
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| 操 作 | 现 象 |
 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为

①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.