题目内容
16.如图是以元素的原子序数为横坐标、原子的最外层电子数为纵坐标所绘出的四种元素的柱状图.
则下列关于四种元素的说法正确的是( )
| A. | W和Z在同一周期 | |
| B. | 原子半径:W<X<Y<Z | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | W和X形成的简单化合物中只含有共价键 |
分析 原子序数为横坐标、原子的最外层电子数为纵坐标,由图可知W为H,X为C,Y为O,Z为Na,
A.W、Z的最外层电子数相同;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
C.非金属性越强,对应氢化物越稳定;
D.W和X形成的简单化合物为甲烷.
解答 解:原子序数为横坐标、原子的最外层电子数为纵坐标,由图可知W为H,X为C,Y为O,Z为Na,
A.W、Z的最外层电子数相同,则位于同主族,在不同的周期,故A错误;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径为W<Y<X<Z,故B错误;
C.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:Y>X,故C正确;
D.W和X形成的简单化合物为甲烷,只含C-H共价键,故D正确;
故选CD.
点评 本题考查原子结构与元素周期律,为高频考点,把握图中信息判断元素、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
6.某化学兴趣小组在探究铝的性质时,发现铝片(没有除去氧化膜)与pH相同(pH=1)的盐酸和硫酸在同温同压下反应时两者产生气体的速率盐酸明显比硫酸快,其可能的原因是( )
| A. | 上述两溶液中盐酸的物质的量浓度比硫酸的物质的量浓度大 | |
| B. | 硫酸使铝钝化 | |
| C. | 生成的氯化铝能溶于水,而生成的硫酸铝难溶于水 | |
| D. | 氯离子可能破坏氧化铝薄膜,而硫酸根离子不能 |
7.能够说明硫的非金属性比氯弱的事实有( )
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态.
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;
④常温时硫单质为固态而氯单质为气态.
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①②③ |
4.下列变化规律正确的是( )
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
11.混合物的分离是化学实验的一项基本内容,以下是中学化学实验中常用的几种分离操作示意图:
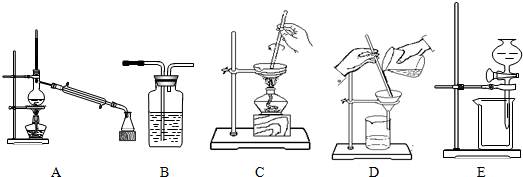
下表中的四项实验都需要进行分离操作,请从上述A~E中选择合适的分离操作,将序号填在表格中.

下表中的四项实验都需要进行分离操作,请从上述A~E中选择合适的分离操作,将序号填在表格中.
| 实验 | 所需分离操作 |
| 1.某活动小组用海水制取粗盐 | |
| 2.某活动小组从原油中分离出汽油、煤油等 | |
| 3.某活动小组将粗盐溶于水,除去其不溶的泥沙 | |
| 4.某活动小组用氢氧化钠溶液洗去CCl4中的I2 |
10.已知:①MnO4-在酸性环境下的还原产物是Mn2+;②草酸是二元弱酸.某校化学兴趣小组进行了下列二项实验活动:
I.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加人相 应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如表所 示(表中“一”表示未加入该试剂).
根据以上4组实验,可以得出的结论主要有稀硫酸可以使上述反应速率加快,升温反应速率加快且温度升高10°C反应速率增大为原来的2.25倍,Mn2+做该反应的催化剂,可加快反应速率
II.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4•2H2O)W g;配制成250mL溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10moI/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2~3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是酸式滴定管
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O.
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为$\frac{31.5V}{W}%$(以含W、V的表达式表示).
I.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加人相 应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如表所 示(表中“一”表示未加入该试剂).
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
II.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4•2H2O)W g;配制成250mL溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10moI/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2~3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是酸式滴定管
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O.
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为$\frac{31.5V}{W}%$(以含W、V的表达式表示).