题目内容
将质量比为7:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为 ;氮原子和氧原子的个数之比为 ;1mol该混合气体的质量为 ;22克该混合气体在标准状况下的体积为 .
考点:物质的量的相关计算
专题:计算题
分析:利用n=
=
=
计算物质的量及其比值,利用构成来计算原子个数比,以此解答.
| m |
| M |
| N |
| NA |
| V |
| Vm |
解答:
解:由质量比为7:15的N2和NO混合,设混合气体中N2和NO的质量分别为28g、60g,
则N2的物质的量为
=1mol,NO的物质的量为
=2mol,
即混合气体中N2和NO的物质的量之比为1mol:2mol=1:2,
氮原子和氧原子的个数比为(1mol×2+2mol×1mol):2mol=2:1,
该混合气体的平均摩尔质量为
=29.3g/mol,即1mol混合气体的质量为:1mol×29.3g/mol=29.3g;
22克该混合气体在标准状况下的体积为:
×22.4L/mol=16.8L,
故答案为:1:2;2:1; 29.3 g; 16.8 L.
则N2的物质的量为
| 28g |
| 28g/mol |
| 60g |
| 30g/mol |
即混合气体中N2和NO的物质的量之比为1mol:2mol=1:2,
氮原子和氧原子的个数比为(1mol×2+2mol×1mol):2mol=2:1,
该混合气体的平均摩尔质量为
| 28g+60g |
| 1mol+2mol |
22克该混合气体在标准状况下的体积为:
| 22 g |
| 29.3g/mol |
故答案为:1:2;2:1; 29.3 g; 16.8 L.
点评:本题考查物质的量的简单计算,巧设物质的质量可简化计算,并熟悉质量与物质的量的关系及常见物质的摩尔质量即可计算解答.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是( )
| A、SO2、O2、HBr |
| B、H2、CH4、O2 |
| C、NH3、CO2、HCl |
| D、NH3、O2、N2 |
下列离子方程式中,书写正确的是( )
| A、硝酸银溶液与铜反应:2Ag++Cu═2Ag+Cu2+ |
| B、氢氧化钠浓溶液与氯化铵溶液混合:NH4++OH-═NH4OH |
| C、在澄清石灰水中通入少量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-═Cu(OH)2↓ |
 Ⅰ.醋酸是我们很熟悉的一种有机物.
Ⅰ.醋酸是我们很熟悉的一种有机物.  的系统命名是:
的系统命名是: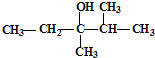 的键线式是
的键线式是 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为