题目内容
100mL1mol?L-1Al2(SO4)3溶液中,含Al3+离子 mol, 个,含SO42-离子 mol, 个.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:1mol?L-1Al2(SO4)3溶液中,c(Al3+)=2mol/L,c(SO42-)=3mol/L,根据n=cV计算Al3+离子、SO42-离子的物质的量,再根据N=nNA计算离子数目.
解答:
解:1mol?L-1Al2(SO4)3溶液中,c(Al3+)=2mol/L,c(SO42-)=3mol/L,
则100mL该溶液中,n(Al3+)=0.1L×2mol/L=0.2mol,故Al3+离子数目=0.2mol×NAmol-1=0.2NA,溶液中n(SO42-)=0.1L×3mol/L=0.3mol,SO42-离子数目=0.3mol×NAmol-1=0.3NA,
故答案为:0.2;0.2NA;0.3;0.3NA.
则100mL该溶液中,n(Al3+)=0.1L×2mol/L=0.2mol,故Al3+离子数目=0.2mol×NAmol-1=0.2NA,溶液中n(SO42-)=0.1L×3mol/L=0.3mol,SO42-离子数目=0.3mol×NAmol-1=0.3NA,
故答案为:0.2;0.2NA;0.3;0.3NA.
点评:本题考查物质的量浓度有关计算,比较基础,侧重对基础知识的巩固,注意理解电解质离子与电解质浓度关系.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
能正确表示下列反应的离子方程式为( )
| A、碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a 克HmX中所含质子的物质的量是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 如图是“康师傅”牌饮用矿泉水标签的部分内容(1mg=10-3g),从中可以推测( )
如图是“康师傅”牌饮用矿泉水标签的部分内容(1mg=10-3g),从中可以推测( )| A、该矿泉水中Mg2+的物质的量浓度的最大值为2×10-4 mol?L-1 |
| B、该矿泉水中Mg2+的物质的量浓度的最大值为1×10-4 mol?L-1 |
| C、1瓶该纯净水中SO42-物质的量的最大值为1×10-3mol |
| D、1瓶该纯净水中Cl-物质的量的最大值为1×10-3mol |
 2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.
2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区.其中,燃煤和汽车尾气是造成空气污染的原因之一.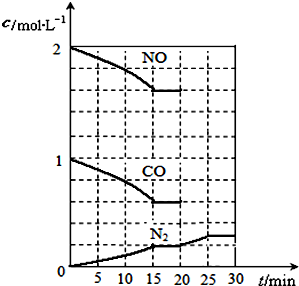 二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.